题目内容
9.对于反应3X(g)+Y(g)?Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):(1)升高温度:增大;
(2)增大压强:增大;
(3)增大容器容积:减小.
分析 影响化学反应速率的因素有温度、浓度、压强、催化剂等,从改变外界条件对活化分子的浓度或百分数的影响角度分析化学反应速率的变化.
解答 解:(1)升高温度,活化分子的百分数增大,反应速率增大,故答案为:增大;
(2)压缩体积,压强增大,反应物的浓度增大,活化分子浓度增大,反应速率增大,故答案为:增大;
(3)增大容器容积,浓度减小,反应速率减小,故答案为:减小.
点评 本题考查外界条件对反应速率的影响,为高频考点,侧重于双基的考查,题目难度不大,注意外界条件对活化分子的影响,注重基础知识的积累.

练习册系列答案
相关题目
8.下列离子方程式正确的是( )
| A. | 稀硝酸与足量的Fe反应的离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 碳酸氢钙溶液中加入过量的氢氧化钠:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向碳酸钙中加入稀盐酸的离子方程式:CO32-+2H+═CO2↑+H2O | |
| D. | 硅酸钠溶液中通入过量二氧化碳:CO2+SiO32-+H2O═H4SiO4↓+CO32- |
9.设NA为阿伏加德罗常数,则下列叙述正确的是( )
| A. | 标准状况下,2.24 CCl4中含有0.4NA个碳氯单键 | |
| B. | 22.4LCl2通入水中充分反应,共转移NA个电子 | |
| C. | 1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA | |
| D. | 5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA |
14.下列有关实验可行的是( )
①可用倒扣在NaOH溶液上面的漏斗装置吸收残余的Cl2
②混入KI溶液中的KHCO3可滴加盐酸除去
③碘升华形成的污迹可用热的浓盐酸洗去
④制Cl2后的黑褐色污迹可用热的浓盐酸洗去.
①可用倒扣在NaOH溶液上面的漏斗装置吸收残余的Cl2
②混入KI溶液中的KHCO3可滴加盐酸除去
③碘升华形成的污迹可用热的浓盐酸洗去
④制Cl2后的黑褐色污迹可用热的浓盐酸洗去.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
19.某原电池的结构如图所示,下列有关该原电池的说法不正确的是( )


| A. | 该电池工作时电能转变为化学能 | B. | 铁片的质量变轻 | ||
| C. | 铜片上发生的反应2H++2e-=H2↑ | D. | SO42-向铁片移动 |

 ,名称是苯乙炔;
,名称是苯乙炔;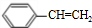 +Br2→
+Br2→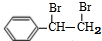 ;
;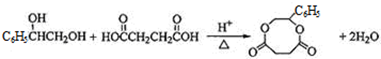 ;
; .
.