题目内容
10.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示: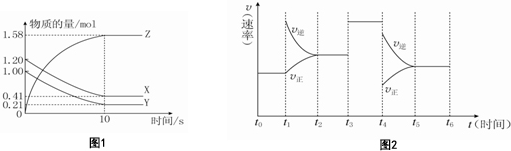
(1)从反应开始到10s时,用Z表示的反应速率为0.079mol•L-1s-1,X的物质的量浓度减少了0.395mol/L,Y的转化率为79.00%.
(2)该反应的化学方程式为X(g)+Y(g)?2Z(g).
(3)该反应的平衡常数表达式为K=$\frac{{c}^{2}(Z)}{c(X)•c(Y)}$,升高温度,平衡常数减小,则该反应为放热反应.
(4)若上述反应在10s后的t1~t6内反应速率与反应时间图象如图2,在每一时刻均改变一个影响反应速率的因素,则t1为增大了生成物的浓度t3为加入催化剂t4为减小压强
分析 (1)根据v=$\frac{△c}{△t}$计算反应速率;结合图象根据c=$\frac{n}{V}$计算浓度变化量,根据转化率=$\frac{变化量}{初始量}$×100%计算转化率;
(2)根据物质的量的变化与化学计量数呈正比书写化学方程式;
(3)该反应的平衡常数等于产物平浓度系数次幂之积和反应物平衡浓度系数次幂之积的比值;根据温度和平衡常数的关系结合平衡移动方向判断反应的吸放热情况;
(4)根据图象,t1时正逆反应速率都增加,平衡逆向移动;t3时平衡不移动;t4时反应速率减小,平衡逆向移动.
解答 解:(1)ν(Z)=$\frac{\frac{1.58mol-0}{2L}}{10s}$=0.079mol/(L•s);X物质的量减少了1.20mol-0.41mol=0.79mol,X的物质的量浓度减少了$\frac{0.79mol}{2L}$=0.395mol/L;Y的物质的量减少了1.00mol-0.21mol=0.79mol,转化率为$\frac{0.79mol}{1.00mol}$×100%=79.00%,故答案为:0.079mol•L-1s-1;0.395mol/L;79.00%;
(2)由图象可以看出,反应到10s时,X的物质的量减小,变化值为1.20mol-0.41mol=0.79mol,Y的物质的量减小,变化值为1.0mol-0.21mol=0.79mol,则X、Y为反应物,Z的物质的量增多,变化值为1.58mol,为生成物,根据物质的量的变化与化学计量数呈正比,
则有n(X):n(Y):n(Z)=0.79mol:0.79mol:1.58mol=1:1:2,所以反应的方程式为X(g)+Y(g)?2Z(g),
故答案为:X(g)+Y(g)?2Z(g);
(3)该反应的平衡常数等于产物平浓度系数次幂之积和反应物平衡浓度系数次幂之积的比值,即K=$\frac{{c}^{2}(Z)}{c(X)•c(Y)}$;升高温度,平衡常数减小,则该反应为放热反应,故答案为:K=$\frac{{c}^{2}(Z)}{c(X)•c(Y)}$;放;
(4)根据图象,t1时增大了生成物的浓度,正逆反应速率都增加,平衡逆向移动;t3时加入了催化剂,平衡不移动;t4时应为减小压强,平衡逆向移动,故答案为:增大了生成物的浓度;加入催化剂;减小压强.
点评 本题考查反应速率的计算以及影响反应速率和平衡移动的因素等平衡图象问题,题目难度不大,注意把握物质的量的变化与化学计量数呈正比,以此书写化学方程式.

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案| A. | 标准状况下,2.24 CCl4中含有0.4NA个碳氯单键 | |
| B. | 22.4LCl2通入水中充分反应,共转移NA个电子 | |
| C. | 1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA | |
| D. | 5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA |
| A. | 过量的NaHSO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | NaHCO3和过量NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | NaHSO4溶液中滴加NaHCO3溶液:H++HCO3-═H2O+CO2↑ | |
| D. | 用NaOH吸收过量的CO2:CO2+OH-═HCO3- |
| A. | 用FeCl3溶液腐蚀铜线路板:Fe3++3Cu═Fe2++3Cu2+ | |
| B. | 少量氨气中通入过量亚硫酸溶液中:NH3+H2SO3═NH4++HSO3- | |
| C. | Cl2与水反应生成盐酸和次氯酸:Cl2+H2O═H++Cl-+HClO | |
| D. | 小苏打溶液中加入过量的烧碱溶液:HCO3-+OH-═CO32-+H2O |

| A. | 该电池工作时电能转变为化学能 | B. | 铁片的质量变轻 | ||
| C. | 铜片上发生的反应2H++2e-=H2↑ | D. | SO42-向铁片移动 |
| A. | 在五水硫酸铜中滴加少量浓硫酸,固体颜色由蓝变白,说明浓硫酸具有吸水性 | |
| B. | 在未知试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀盐酸不溶解,说明原未知试液中含有SO42- | |
| C. | 在铜片上滴加少量稀硫酸,无明显现象,说明稀硫酸没有氧化性 | |
| D. | 某未知气体通入品红溶液中,品红溶液褪色,则原气体一定是 SO2 |
 硫及其化合物广泛存在于自然界中,回答下列问题:
硫及其化合物广泛存在于自然界中,回答下列问题: