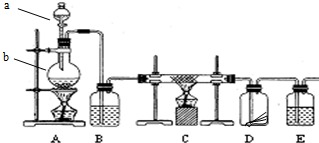
题目内容
2. 某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.
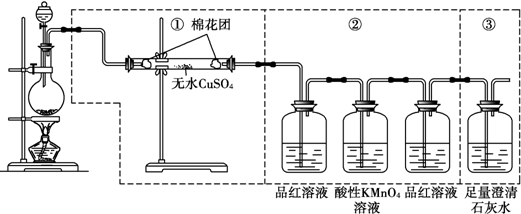
某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.【查阅资料】SO2只有在水存在的情况下才能与Br2发生反应.
(1)加热一段时间,常会看到烧瓶中液体变黑,原因是反应产生了部分乙醇炭化.
(2)连接装置A-C,由品红褪色的现象可以证明气体产物中含有SO2,写出A中黑色物质参与反应产生该气体的方程式C+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+H2O.
(3)连接装置A-B-C-D,当观察到C中品红不褪色,D中酸性KMnO4溶液褪色的现象时,证明制得乙烯.
(4)连接装置A-B-E-D,发现通入D之前的石灰水中无明显变化,通入D之后的石灰水变浑浊.请对出现该现象的原因进行合理猜想乙烯被酸性酸性KMnO4溶液氧化为CO2.
(5)A中产生的三种混合气体干燥后,依次通过装置G-C-F-E可以将三种气体逐一检验出,首先由G检验出的气体是乙烯,证明CO2存在的现象是F中溴水不褪色,E中澄清石灰水变浑浊.
分析 浓硫酸和乙醇在加热条件下发生反应生成乙烯,因浓硫酸具有脱水性和强氧化性,可生成C、二氧化碳、二氧化硫等,二氧化硫可使品红褪色,可与氢氧化钠溶液反应,检验乙烯,应先通过氢氧化钠溶液,然后用高锰酸钾或溴水检验乙烯,可先用溴的四氯化碳溶液检验乙烯,在用品红检验二氧化硫,用溴水除去二氧化硫,最后用澄清石灰水检验二氧化碳,以此解答该题.
解答 解:(1)因浓硫酸具有脱水性,常会看到烧瓶中液体变黑,原因是部分乙醇发生碳化,故答案为:部分乙醇炭化;
(2)因二氧化硫具有漂白性,品红褪色,可说明生成二氧化硫,黑色物质为碳,与浓硫酸反应生成二氧化硫,方程式为C+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+H2O,
故答案为:SO2;C+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+H2O;
(3)连接装置A-B-C-D,可用氢氧化钠除去二氧化碳、二氧化硫,且C中品红不褪色,D中酸性KMnO4溶液褪色,说明反应生成乙烯,因乙烯可与酸性高锰酸钾发生氧化还原反应,
故答案为:C中品红不褪色,D中酸性KMnO4溶液褪色;
(4)连接装置A-B-E-D,二氧化硫、二氧化碳被氢氧化钠溶液吸收,乙烯雨高锰酸钾发生氧化还原反应生成二氧化碳,可导致通入D之前的石灰水中无明显变化,通入D之后的石灰水变浑浊,
故答案为:乙烯被酸性酸性KMnO4溶液氧化为CO2;
(5)SO2只有在水存在的情况下才能与Br2发生反应,可先将混合气体通过溴的四氯化碳,可除去乙烯,然后用品红除去二氧化硫,用溴水检验二氧化硫是否除尽,如E中澄清石灰水变浑浊,说明生成二氧化碳,故答案为:乙烯;F中溴水不褪色,E中澄清石灰水变浑浊.
点评 本题考查浓硫酸与乙醇的消去反应的实验,为高考常见题型和高频考点,题目难度中等,试题题量较大,知识点较多,综合性较强,注意掌握乙醇、乙烯的化学性质,明确乙烯的检验方法,试题充分考查了学生的分析、理解能力及化学实验能力.

| A. | 任何化学反应都伴随着能量的变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 化学反应中的能量变化都是以热量的形式体现 | |
| D. | 2CO(g)+O2(g)═2CO2(g)△H<0,则56g CO和32g O2所具有的总能量小于88g CO2所具有的总能量 |
| A. | 采用加热蒸干高锰酸钾溶液的方法获得高锰酸钾晶体 | |
| B. | 过滤时,为了加快过滤速率,可用玻璃棒在漏斗内搅拌 | |
| C. | 用冷却结晶法提纯含有少量氯化钠杂质的硝酸钾固体 | |
| D. | 某无色溶液中加入稀盐酸无现象,再加Ba(NO3)2溶液,产生白色沉淀,则原溶液中一定有SO42- |
| A. | 在镀件上电镀锌,用锌作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制氯气,用涂镍碳钢网作阴极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |