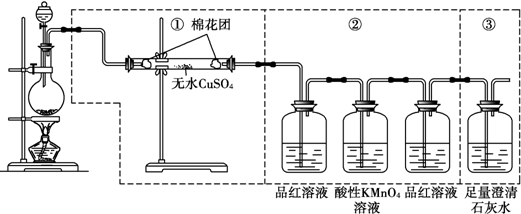
题目内容
19.下列药品,在空气中既不易被氧化,也不易分解,且可以用无色玻璃瓶存放的是( )| A. | 氯水 | B. | 钠 | C. | 浓硝酸 | D. | 浓盐酸 |
分析 A.氯水中次氯酸不稳定,见光分解;
B.钠性质活泼,易与水、氧气反应;
C.浓硝酸见光分解;
D.浓硫酸性质稳定,不易分解、不易被氧化.
解答 解:A.氯水中次氯酸不稳定,见光分解,应保存在棕色瓶中,故A错误;
B.钠性质活泼,易被水、氧气氧化,故B错误;
C.浓硝酸见光分解,应保存在棕色瓶中,故C错误;
D.浓盐酸性质稳定,既不易被氧化,也不易分解,且可以用无色玻璃瓶存放,故D正确;
故选:D.
点评 本题考查了常见化学试剂的保存方法判断,题目难度不大,注意掌握常见化学试剂的性质及正确的保存方法,正确理解题干要求是解答本题关键.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
9.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
| A. | 甲的摩尔体积比乙的摩尔体积小 | |
| B. | 甲的物质的量比乙的物质的量多 | |
| C. | 甲的相对分子质量比乙的相对分子质量小 | |
| D. | 甲的分子数比乙的分子数少 |
10.研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是酸雨,潮湿条件下,写出大气中SO2转化为HSO3-的方程式SO2+H2O?H2SO3;H2SO3?H++HSO3-.
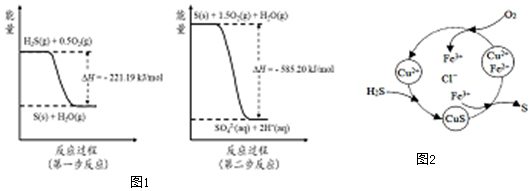
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39kJ•mol-1.
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g),过程中测定的部分数据见表:
①反应在0~4min内的平均速率为v(SO2)=6.25×10-3mol/(L•min);
②此温度下该反应的化学平衡常数K=225(mol/L),
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将减小(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有通入足量的空气.
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:K a1=1.3×10-7,K a2=7.1×10-15,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度反应很难进行.
(1)SO2的大量排放会引起严重的环境问题是酸雨,潮湿条件下,写出大气中SO2转化为HSO3-的方程式SO2+H2O?H2SO3;H2SO3?H++HSO3-.
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39kJ•mol-1.
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g),过程中测定的部分数据见表:
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
②此温度下该反应的化学平衡常数K=225(mol/L),
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将减小(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有通入足量的空气.
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:K a1=1.3×10-7,K a2=7.1×10-15,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度反应很难进行.

7.下列实验设计和结论正确的是( )
| A. | 采用加热蒸干高锰酸钾溶液的方法获得高锰酸钾晶体 | |
| B. | 过滤时,为了加快过滤速率,可用玻璃棒在漏斗内搅拌 | |
| C. | 用冷却结晶法提纯含有少量氯化钠杂质的硝酸钾固体 | |
| D. | 某无色溶液中加入稀盐酸无现象,再加Ba(NO3)2溶液,产生白色沉淀,则原溶液中一定有SO42- |
14.常温下,下列盐溶液 pH<7的是( )
| A. | NaHCO3溶液 | B. | NaHSO3溶液 | C. | CH3COONa溶液 | D. | Na2HPO4溶液 |
11.下列描述中,不符合生产实际的是( )
| A. | 在镀件上电镀锌,用锌作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制氯气,用涂镍碳钢网作阴极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |