题目内容
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2?6H2O的流程如下:
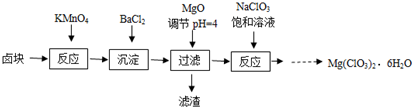
已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )

已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )
| A、卤块中加入KMnO4发生的氧化还原反应有2个 |
| B、加入BaCl2为沉淀SO42- |
| C、也可用Mg(OH)2代替MgO调节溶液的PH |
| D、在滤液中加NaClO3饱和溶液得到产品利用了相同温度下Mg(ClO3)2溶解度比NaClO3小 |
考点:制备实验方案的设计
专题:实验设计题
分析:卤块的成分有MgCl2?6H2O、MgSO4、FeCl2,加入高锰酸钾之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀;加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁溶液,向滤液中进入饱和氯酸钠溶液析出Mg(ClO3)2,说明相同温度下Mg(ClO3)2溶解度较小,据此对各选项进行判断.
解答:
解:A.卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质,进入KMnO4发生的氧化还原反应只有1个,即亚铁离子与高锰酸根离子的反应,故A错误;
B.卤块中含有杂质硫酸根离子,进入氯化钡的目的是使硫酸根离子与钡离子反应生成硫酸钡沉淀,故B正确;
C.氢氧化镁和氧化镁都属于难溶物,且氢氧化镁的溶解度都小于氢氧化铁,所以也可用Mg(OH)2代替MgO调节溶液的pH,从而沉淀出氢氧化铁,故C正确;
D.在滤液中加NaClO3饱和溶液,发生反应为:MgCl2+2NaClO3═Mg(ClO3)2↓+2NaCl,原理是相同温度下Mg(ClO3)2溶解度比NaClO3小,故D正确;
故选A.
B.卤块中含有杂质硫酸根离子,进入氯化钡的目的是使硫酸根离子与钡离子反应生成硫酸钡沉淀,故B正确;
C.氢氧化镁和氧化镁都属于难溶物,且氢氧化镁的溶解度都小于氢氧化铁,所以也可用Mg(OH)2代替MgO调节溶液的pH,从而沉淀出氢氧化铁,故C正确;
D.在滤液中加NaClO3饱和溶液,发生反应为:MgCl2+2NaClO3═Mg(ClO3)2↓+2NaCl,原理是相同温度下Mg(ClO3)2溶解度比NaClO3小,故D正确;
故选A.
点评:本题通过Mg(ClO3)2?6H2O的制备,考查了物质制备实验方案的设计方法,题目难度中等,正确分析制备流程及反应原理为解答本题的关键,要求学生掌握物质制备方案的设计方法,试题考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32-、Cl-、SO42-,为确认溶液的组成,现取100mL分成三等份溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58g,同时收集到气体0.03mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99g.
由此可知,下列关于原溶液组成的正确结论是( )
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58g,同时收集到气体0.03mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99g.
由此可知,下列关于原溶液组成的正确结论是( )
| A、溶液中SO42-的浓度是0.3 mol/L |
| B、溶液中一定含有A13+和NH4+ |
| C、一定不存在Mg2+,可能存在A13+ |
| D、一定存在Cl- 可能含CO32- |
与乙炔具有相同的碳、氢百分含量,但既不是同系物又不是同分异构体的是( )
| A、丙炔 | B、环丁烷 | C、甲苯 | D、苯 |
用水稀释0.1mol/L氨水时,溶液中随水量的增加而增大的是( )
| A、c(H+)和c(OH-)的乘积 | ||||
B、
| ||||
C、
| ||||
| D、pH值 |
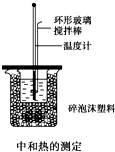 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

 如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题:
如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题: