题目内容
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成.
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成.
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现.
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.
根据实验现象回答:待测液中一定含有 离子,一定不含有 离子,请写出(1)、(2)、(4)发生反应的离子方程式:(1) (2) (4) .
(1)加入过量的稀盐酸,有白色沉淀生成.
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成.
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现.
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.
根据实验现象回答:待测液中一定含有
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:(1)加入过量盐酸有白色沉淀生成,说明一定含有银离子;
(2)在滤液中加入过量的稀硫酸,又有白色沉淀生成说明含有钡离子;
(3)滴入2滴KSCN溶液,没有明显的现象出现,证明无铁离子;
(4)加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体,证明含有铵根离子.
(2)在滤液中加入过量的稀硫酸,又有白色沉淀生成说明含有钡离子;
(3)滴入2滴KSCN溶液,没有明显的现象出现,证明无铁离子;
(4)加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体,证明含有铵根离子.
解答:
解:氯离子和银离子反应生成白色沉淀,所以根据实验(1)现象判断一定有Ag+;
钡离子和硫酸根离子反应生成白色沉淀,根据实验(2)现象判断一定有Ba2+;
Fe3+与KSCN反应使溶液呈血红色,根据实验(3)现象判断一定没有Fe3+;
铵根离子和碱在加热条件下能反应生成刺激性气味的氨气,根据实验(4)现象判断一定有NH4+;
(1)氯离子和银离子生成氯化银白色沉淀,Ag++Cl-=AgCl↓;
(2)钡离子和硫酸根离子反应生成硫酸钡白色沉淀,Ba2++SO42-=BaSO4↓;
(4)铵根离子和碱在加热条件下能反应生成刺激性气味的氨气,NH4++OH-
NH3↑+H2O.
故答案为:Ag+、Ba2+、NH4+;Fe3+;
(1)Ag++Cl-=AgCl↓;
(2)Ba2++SO42-=BaSO4↓
(4)NH4++OH-
NH3↑+H2O.
钡离子和硫酸根离子反应生成白色沉淀,根据实验(2)现象判断一定有Ba2+;
Fe3+与KSCN反应使溶液呈血红色,根据实验(3)现象判断一定没有Fe3+;
铵根离子和碱在加热条件下能反应生成刺激性气味的氨气,根据实验(4)现象判断一定有NH4+;
(1)氯离子和银离子生成氯化银白色沉淀,Ag++Cl-=AgCl↓;
(2)钡离子和硫酸根离子反应生成硫酸钡白色沉淀,Ba2++SO42-=BaSO4↓;
(4)铵根离子和碱在加热条件下能反应生成刺激性气味的氨气,NH4++OH-
| ||
故答案为:Ag+、Ba2+、NH4+;Fe3+;
(1)Ag++Cl-=AgCl↓;
(2)Ba2++SO42-=BaSO4↓
(4)NH4++OH-
| ||
点评:本题考查常见阳离子的检验,阳离子的检验方法有:常规检验法、焰色反应、特殊检验法;离子检验时,要注意排除其它离子的干扰.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
下列物质中PH值最大的是( )
| A、0.0001mol/L的HCl |
| B、0.00001mol/L的H2SO4 |
| C、0.0000001mol/L的NaOH |
| D、纯水 |
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2?6H2O的流程如下:
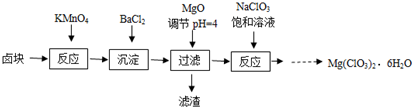
已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )

已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )
| A、卤块中加入KMnO4发生的氧化还原反应有2个 |
| B、加入BaCl2为沉淀SO42- |
| C、也可用Mg(OH)2代替MgO调节溶液的PH |
| D、在滤液中加NaClO3饱和溶液得到产品利用了相同温度下Mg(ClO3)2溶解度比NaClO3小 |
 如图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y不可能是( )
如图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y不可能是( )