题目内容
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深.
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2?xMgCO3]
(2)为了确定产物,进行以下定性实验:
实验Ⅲ中洗涤的操作方法是 .
(3)为进一步确定实验I的白色不溶物的成分,进行以下定量实验,装置如图所示:

称取干燥、纯净的白色不溶物 4.52g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验后装置A增重0.36g,装置B增重1.76g.装置C的作用是 ;白色不溶物的化学式为 .
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式 .
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深.
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2?xMgCO3]
(2)为了确定产物,进行以下定性实验:
| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧, 火焰呈淡蓝色 | 气体成分为 |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 | 白色不溶物中含有MgCO3 | |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- 离子 |
(3)为进一步确定实验I的白色不溶物的成分,进行以下定量实验,装置如图所示:

称取干燥、纯净的白色不溶物 4.52g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验后装置A增重0.36g,装置B增重1.76g.装置C的作用是
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式
考点:性质实验方案的设计
专题:实验设计题
分析:(1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3;
(2)依据实验Ⅱ的现象分析,镁条和碳酸氢钠溶液迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变分析出是氢气;
依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;
依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子;
实验Ⅲ中洗涤的操作方法是用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍;
(3)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以B不能直接与空气接触,为了防止空气中的水蒸气和CO2进入装置B中,影响实验结果,所以应连接一个干燥装置除去空气中的水蒸气和CO2;根据B中碱石灰质量的增加量就是生成的二氧化碳的质量计算出碳酸镁的质量,剩余的就是氢氧化镁的质量;
(4)根据分析、计算可知,镁与碳酸氢钠溶液反应生成Mg(OH)2?2MgCO3、碳酸钠和氢气,据此写出反应的化学方程式.
(2)依据实验Ⅱ的现象分析,镁条和碳酸氢钠溶液迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变分析出是氢气;
依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;
依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子;
实验Ⅲ中洗涤的操作方法是用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍;
(3)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以B不能直接与空气接触,为了防止空气中的水蒸气和CO2进入装置B中,影响实验结果,所以应连接一个干燥装置除去空气中的水蒸气和CO2;根据B中碱石灰质量的增加量就是生成的二氧化碳的质量计算出碳酸镁的质量,剩余的就是氢氧化镁的质量;
(4)根据分析、计算可知,镁与碳酸氢钠溶液反应生成Mg(OH)2?2MgCO3、碳酸钠和氢气,据此写出反应的化学方程式.
解答:
解:(1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3,故答案为:Mg(OH)2 ;
(2)迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气;
依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;
依据实验Ⅳ加入CaCl2或BaCl2生成沉淀证明含有碳酸根离子,
实验Ⅲ中洗涤的操作方法是用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍;
故答案为:氢气;稀盐酸;产生气泡沉淀全部溶解;CaCl2或BaCl2;用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍;
(3)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以B不能直接与空气接触,为了防止空气中的水蒸气和CO2进入装置B中,影响实验结果,所以应连接一个干燥装置除去空气中的水蒸气和CO2;
B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为8.8g,设生成8.8g二氧化碳,需要碳酸镁的质量为X则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X 8.8g
根据:
=
解得X=16.8g,所以含有氢氧化镁质量为:22.6g-16.8g=5.8g;
碳酸镁和氢氧化镁物质的量之比为:
:
=0.2:0.1=2:1,白色不溶物的化学式为Mg(OH)2(CO3)2或2MgCO3?Mg(OH)2,
故答案为:防止空气中的水蒸气和CO2进入装置B中,影响实验结果;Mg(OH)2(CO3)2或2MgCO3?Mg(OH)2 ;
(4)根据以上分析可知,镁与饱和碳酸氢钠溶液反应生成2Mg(OH)2?2MgCO3沉淀、Na2CO3和H2,反应的化学方程式为:3Mg+4NaHCO3+2H2O=Mg(OH)2?2MgCO3↓+2Na2CO3+3H2↑;故答案为:3Mg+4NaHCO3+2H2O=Mg(OH)2?2MgCO3↓+2Na2CO3+3H2↑;
(2)迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气;
依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;
依据实验Ⅳ加入CaCl2或BaCl2生成沉淀证明含有碳酸根离子,
实验Ⅲ中洗涤的操作方法是用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍;
故答案为:氢气;稀盐酸;产生气泡沉淀全部溶解;CaCl2或BaCl2;用玻璃棒引流,向过滤器(或漏斗)中注入蒸馏水至浸没沉淀,等水自然流尽后,重复2~3遍;
(3)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以B不能直接与空气接触,为了防止空气中的水蒸气和CO2进入装置B中,影响实验结果,所以应连接一个干燥装置除去空气中的水蒸气和CO2;
B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为8.8g,设生成8.8g二氧化碳,需要碳酸镁的质量为X则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X 8.8g
根据:
| 84 |
| 44 |
| x |
| 8.8 |
碳酸镁和氢氧化镁物质的量之比为:
| 16.8g |
| 84g/mol |
| 5.8g |
| 58g/mol |
故答案为:防止空气中的水蒸气和CO2进入装置B中,影响实验结果;Mg(OH)2(CO3)2或2MgCO3?Mg(OH)2 ;
(4)根据以上分析可知,镁与饱和碳酸氢钠溶液反应生成2Mg(OH)2?2MgCO3沉淀、Na2CO3和H2,反应的化学方程式为:3Mg+4NaHCO3+2H2O=Mg(OH)2?2MgCO3↓+2Na2CO3+3H2↑;故答案为:3Mg+4NaHCO3+2H2O=Mg(OH)2?2MgCO3↓+2Na2CO3+3H2↑;
点评:本题难度较大,考查全面,从定性和定量两个方面测定物质的种类,关键在于知道碳酸根离子与酸反应能产生二氧化碳,镁和氢离子反应生成氢气,题目难度较大.

练习册系列答案
相关题目
下列物质中PH值最大的是( )
| A、0.0001mol/L的HCl |
| B、0.00001mol/L的H2SO4 |
| C、0.0000001mol/L的NaOH |
| D、纯水 |
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2?6H2O的流程如下:
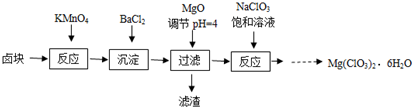
已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )

已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )
| A、卤块中加入KMnO4发生的氧化还原反应有2个 |
| B、加入BaCl2为沉淀SO42- |
| C、也可用Mg(OH)2代替MgO调节溶液的PH |
| D、在滤液中加NaClO3饱和溶液得到产品利用了相同温度下Mg(ClO3)2溶解度比NaClO3小 |
下列叙述正确的是( )
| A、浓度均为0.1mol?L-1的小苏打溶液与烧碱溶液等体积混合c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| B、某二元酸(H2A)在水中的电离方程式是:H2A=H++HA-,HA-?H++A2-;则NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| C、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、常温下,10mLpH=12的Ba(OH)2溶液与40mLcmol?-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50mL,则溶液pH=11 |
乙炔的空间构型是( )
| A、正四面体 | B、平面型 |
| C、直线型 | D、三角锥形 |
 用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A、正反应速率:v(a)>v(c) v(b)>v(d) | ||||||||
| B、平衡时a点一定有n(CO):n(H2)=1:2 | ||||||||
| C、平衡常数:K(a)>K(c) K(b)=K(d) | ||||||||
D、平均摩尔质量:
|
 如图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y不可能是( )
如图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y不可能是( )