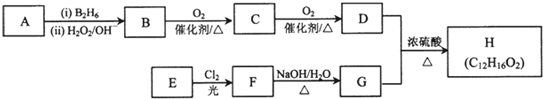
题目内容
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如图所示:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ;
(2)写出有关离子方程式:步骤①中生成A ;步骤②生成沉淀I .
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明该溶液不能确定的阴离子存在的理由是 .

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是
(2)写出有关离子方程式:步骤①中生成A
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明该溶液不能确定的阴离子存在的理由是
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,
生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,
溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,
溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,
溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答.
生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,
溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,
溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,
溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答.
解答:
解:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
(1)中除H+外还肯定含有的离子是Al3+、NH4+、Fe2+、SO42-,故答案为:Al3+、NH4+、Fe2+、SO42-;
(2)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O; ②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,则生成沉淀的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知Fe2+物质的量为0.03mol; 碳溶液中正电荷为:2n(Fe2+)+3n(Al3+)+n(NH4+)+n(H+)=2×0.03mol+3×0.01mol+0.01mol+0.04mol=0.14mol;沉淀C为硫酸钡,其物质的量0.07mol,n(SO42-)=0.07mol,硫酸根离子所带的负电荷为:0.07mol×2=0.14mol,说明溶液中正负电荷相等,所以若检验Fe3+肯定存在时,就有Cl-存在,因肯定存在的离子电荷总数已相等,
故答案为:若检验Fe3+肯定存在时,就有Cl-存在,因肯定存在的离子电荷总数已相等.
(1)中除H+外还肯定含有的离子是Al3+、NH4+、Fe2+、SO42-,故答案为:Al3+、NH4+、Fe2+、SO42-;
(2)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O; ②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,则生成沉淀的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知Fe2+物质的量为0.03mol; 碳溶液中正电荷为:2n(Fe2+)+3n(Al3+)+n(NH4+)+n(H+)=2×0.03mol+3×0.01mol+0.01mol+0.04mol=0.14mol;沉淀C为硫酸钡,其物质的量0.07mol,n(SO42-)=0.07mol,硫酸根离子所带的负电荷为:0.07mol×2=0.14mol,说明溶液中正负电荷相等,所以若检验Fe3+肯定存在时,就有Cl-存在,因肯定存在的离子电荷总数已相等,
故答案为:若检验Fe3+肯定存在时,就有Cl-存在,因肯定存在的离子电荷总数已相等.
点评:本题考查物质的检验与鉴别,属于中等难度的试题,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率,要依据物质的特殊性质和特征反应来判断、推理、验证.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?cC(g),符合如图所示的关系(c%表示混合气中产物C的百分含量,T表示温度,P表示压强,t表示时间).在图中,Y轴是指( )
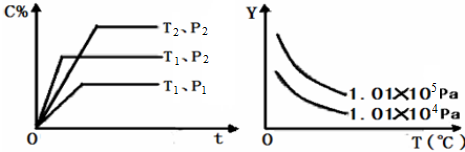

| A、平衡混合气中物质A的百分含量 |
| B、平衡混合气中物质B的百分含量 |
| C、平衡混合气的平均摩尔质量 |
| D、平衡混合气的密度 |
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2?6H2O的流程如下:
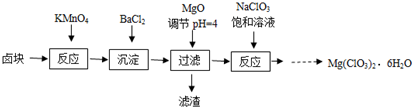
已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )

已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )
| A、卤块中加入KMnO4发生的氧化还原反应有2个 |
| B、加入BaCl2为沉淀SO42- |
| C、也可用Mg(OH)2代替MgO调节溶液的PH |
| D、在滤液中加NaClO3饱和溶液得到产品利用了相同温度下Mg(ClO3)2溶解度比NaClO3小 |