题目内容
用水稀释0.1mol/L氨水时,溶液中随水量的增加而增大的是( )
| A、c(H+)和c(OH-)的乘积 | ||||
B、
| ||||
C、
| ||||
| D、pH值 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:加水稀释促进一水合氨电离,溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都减小,温度不变,水的离子积常数不变,则c(H+)增大.
解答:
解:加水稀释促进一水合氨电离,溶液中氢氧根离子浓度、一水合氨浓度、铵根离子浓度都减小,但c(H+)增大,
A.温度不变,水的离子积常数不变,所以c(H+)和c(OH-)的乘积不变,故A错误;
B.根据加水稀释时,电离平衡常数不变,则
不变,又c(NH4+)减小,所以
减小,故B错误;
C.加水稀释促进一水合氨电离,则铵根离子个数增大、一水合氨个数减小,所以
增大,故C正确;
D.加水稀释促进一水合氨电离,则c(OH-)减小,PH值减小,故D错误;
故选C.
A.温度不变,水的离子积常数不变,所以c(H+)和c(OH-)的乘积不变,故A错误;
B.根据加水稀释时,电离平衡常数不变,则
| c(OH -)C(NH 4 +) |
| c(NH 3?H 2O) |
| c(NH 3?H 2O) |
| C(OH -) |
C.加水稀释促进一水合氨电离,则铵根离子个数增大、一水合氨个数减小,所以
| c(NH 4 +) |
| c(NH 3?H 2O) |
D.加水稀释促进一水合氨电离,则c(OH-)减小,PH值减小,故D错误;
故选C.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,根据溶液中离子浓度变化来分析解答,注意:所有的平衡常数只与温度有关,与溶液浓度、溶液酸碱性无关,为易错点.

练习册系列答案
相关题目
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2?6H2O的流程如下:
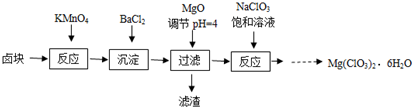
已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )

已知:卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质.下列说法不正确的是( )
| A、卤块中加入KMnO4发生的氧化还原反应有2个 |
| B、加入BaCl2为沉淀SO42- |
| C、也可用Mg(OH)2代替MgO调节溶液的PH |
| D、在滤液中加NaClO3饱和溶液得到产品利用了相同温度下Mg(ClO3)2溶解度比NaClO3小 |
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y?2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
| A、33% | B、40% |
| C、50% | D、67% |
 用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A、正反应速率:v(a)>v(c) v(b)>v(d) | ||||||||
| B、平衡时a点一定有n(CO):n(H2)=1:2 | ||||||||
| C、平衡常数:K(a)>K(c) K(b)=K(d) | ||||||||
D、平均摩尔质量:
|
相同物质的量的镁和铝分别与足量的稀盐酸反应,生成氢气的质量之比为( )
| A、1:1 | B、2:3 |
| C、3:4 | D、2:1 |
下列实验方法或操作:
①用100mL筒量配制60mL10% 的盐酸;②称量没有腐蚀性固体药品时,把药品放在托盘上称量;③浓硫酸沾到皮肤上要先用抹布擦再用大量水冲洗;④用托盘天平称取5.20gNaCl晶体;⑤蒸馏开始时应先加热在开冷凝水;⑥萃取操作时选择的萃取剂的密度不必比水大;⑦用容量瓶配制一定浓度的某溶液后,将溶液保存在容量瓶中并贴上标签.其中正确的是( )
①用100mL筒量配制60mL10% 的盐酸;②称量没有腐蚀性固体药品时,把药品放在托盘上称量;③浓硫酸沾到皮肤上要先用抹布擦再用大量水冲洗;④用托盘天平称取5.20gNaCl晶体;⑤蒸馏开始时应先加热在开冷凝水;⑥萃取操作时选择的萃取剂的密度不必比水大;⑦用容量瓶配制一定浓度的某溶液后,将溶液保存在容量瓶中并贴上标签.其中正确的是( )
| A、③⑥ | B、②③⑦ |
| C、①③⑥ | D、③⑤⑥ |
下列关于钠的叙述中不正确的是( )
| A、钠具有很强的还原性 |
| B、钠原子的最外层只有一个电子 |
| C、在实验室中,钠通常保存在石蜡油或煤油中 |
| D、钠在常温下不易被氧化 |
 ,违背了
,违背了