题目内容
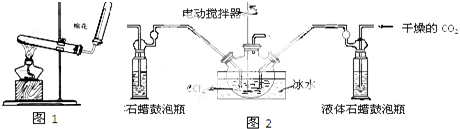
8.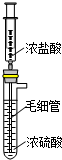 实验室用如图装置制备HCl气体.
实验室用如图装置制备HCl气体.(1)推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥HCl气体,其原理是ab(选填编号).
a.浓硫酸吸收了盐酸中水分
b.混合时放热使HCl溶解度减小
c.浓盐酸中HCl以分子形式存在
d.浓盐酸密度小于浓硫酸
为测定制备气体后残留混合酸中盐酸和硫酸的浓度,进行如下实验:
(2)取5.00mL混合酸,加水稀释至500mL,完成此操作,用到的精确定量仪器有酸性滴定管、500mL容量瓶;
称量4.7880g Ba(OH)2固体,溶于水配成250mL标准溶液,装入洗净的细口试剂瓶,并贴上标签.装瓶前用标准溶液对试剂瓶进行润洗的目的是避免滴定液被稀释,引起实验误差,请你填写标签上的空白.
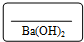
(3)从500mL稀释液中取出20.00mL,滴加几滴酚酞作指示剂,用标准Ba(OH)2溶液滴定至溶液由无色变为红色才停止滴定,出现这种情况的补救措施除重做外,还有可以采取的措施是用待测酸液滴定至溶液立即由红色变为浅红色(且半分钟不褪色).
(4)为完成全部测定,接下来对锥形瓶中混合物进行的操作是过滤、洗涤、干燥、称量、恒重.
(5)若固体Ba(OH)2中混有少量的NaOH,会导致混合酸中硫酸浓度的测定结果无影响(选填“偏大”、“偏小”、“无影响”).
分析 (1)浓硫酸吸水,放出大量的热,有利于HCl的逸出;
(2)由量取混合酸体积精度,可以选择酸式滴定管量取,由配制溶液体积可知在500mL容量瓶中定容;
装瓶前用标准溶液对试剂瓶进行润洗,避免滴定液被稀释,引起实验误差;
标签应注明物质的量浓度,根据n=$\frac{m}{M}$计算氢氧化钡物质的量,再根据c=$\frac{n}{V}$计算氢氧化钡溶液浓度;
(3)用标准Ba(OH)2溶液滴定至溶液由无色变为红色才停止滴定,出现这种情况的补救措施除重做外,还有可以采取的措施是:用待测酸液滴定至溶液立即由红色变为浅红色(且半分钟不褪色);
(4)反应生成硫酸钡沉淀,进行过滤、洗涤、干燥,称量硫酸钡的质量,恒重时可得硫酸钡质量,根据硫酸根守恒可以计算硫酸的浓度,氢离子源于硫酸与HCl,结合氢氧根离子中和氢离子,可以计算HCl的物质的量浓度;
(5)硫酸转化为硫酸钡沉淀,根据硫酸钡的质量,由硫酸根守恒计算硫酸的物质的量.
解答 解:(1)浓硫酸吸水,放出大量的热,使HCl溶解度减小,有利于HCl的逸出,可制备少量干燥HCl气体,
故选:ab;
(2)由量取混合酸体积精度,可以选择酸式滴定管量取,由配制溶液体积可知在500mL容量瓶中定容;
装瓶前用标准溶液对试剂瓶进行润洗,避免滴定液被稀释,引起实验误差;
标签应注明物质的量浓度,氢氧化钡物质的量为$\frac{4.7880g}{171g/mol}$=0.02800mol,氢氧化钡溶液浓度为$\frac{0.02800mol}{0.25L}$=0.1120mol/L,
故答案为:酸式滴定管、500mL容量瓶;避免滴定液被稀释,引起实验误差;0.1120mol/L;
(3)用标准Ba(OH)2溶液滴定至溶液由无色变为红色才停止滴定,出现这种情况的补救措施除重做外,还有可以采取的措施是:用待测酸液滴定至溶液立即由红色变为浅红色(且半分钟不褪色),
故答案为:用待测酸液滴定至溶液立即由红色变为浅红色(且半分钟不褪色);
(4)反应生成硫酸钡沉淀,进行过滤、洗涤、干燥,称量硫酸钡的质量,恒重时可得硫酸钡质量,根据硫酸根守恒可以计算硫酸的浓度,氢离子源于硫酸与HCl,结合氢氧根离子中和氢离子,可以计算HCl的物质的量浓度,
故答案为:过滤、洗涤、干燥;恒重;
(5)硫酸转化为硫酸钡沉淀,根据硫酸钡的质量,由硫酸根守恒计算硫酸的物质的量,固体Ba(OH)2中混有少量的NaOH,不影响混合酸中硫酸浓度的测定结果,
故答案为:无影响.
点评 本题考查滴定原理的应用、一定物质的量浓度溶液配制等,属于定量实验,关键是对原理的理解,(2)中注意有效数字问题,难度中等.

 金博士一点全通系列答案
金博士一点全通系列答案①消去反应②取代反应③加成反应④水解反应.
| A. | ①② | B. | ①②③ | C. | ②③ | D. | ①②③④ |
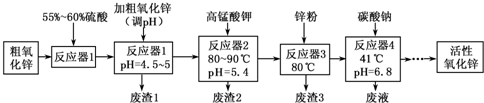
| Fe(OH)2 | Fe( OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
| 开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
| 沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
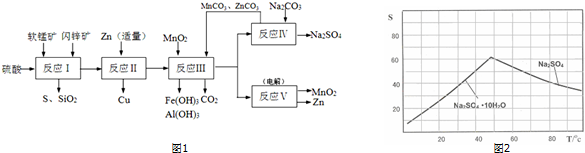
(1)“废渣1”的主要成分是Fe( OH)3.
(2)完成“反应器2”中反应之一的离子方程式:□MnO-4+□Mn2++□2H2O=□MnO2↓+□H+
(3)蘸取“反应器2”中的溶液点在淀粉碘化钾试纸上,如果观察到试纸变蓝,说明KMnO4过量.
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H=-174.6kJ•mol-1
C(s)+CO2(g)═2CO(g)△H=+283.0kJ•mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H=-228.8kJ/mol.
(5)“反应器3”中加入锌粉的作用是调节溶液pH,除去溶液中Cu2+.
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有K+、SO42-.
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO2 0.224L,碱式碳酸锌的化学式ZnCO3•2Zn(OH)2•H2O.
| A. | 3.2gO2、O3组成的混合物中含有的质子数为1.6NA | |
| B. | 当反应6HCl+KClO3═Cl2↑+KC1+3H2O有71gC l2生成时,转移电子数目为2NA | |
| C. | 1molC2H4分子中含共用电子对的数自为5NA | |
| D. | 0.1mol乙醇与足量乙酸充分反应后,生成的水分子数目为0.1NA |
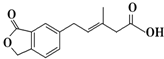
| A. | M可以发生加成、加聚、水解、酯化等反应 | |
| B. | 1mol M最多可以与3mol NaOH反应 | |
| C. | M苯环上的一氯取代物有三种不同结构 | |
| D. | 1mol M最多可以与5mol H2发生加成反应 |
| A. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| B. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 | |
| C. | 同系物的分子量数值一定相差14的整数倍 | |
| D. | 同系物的化学性质相似,物理性质随碳原子数的递增呈现规律性变化 |