题目内容
14.化学与材料、能源、环境等密切联系.下列说法不正确的是( )| A. | 研发光电转换材料,充分利用太阳能 | |
| B. | 包装材料聚氯乙烯属于烃,会造成环境污染 | |
| C. | 用石灰对煤燃烧形成的烟气脱硫,并回收石膏 | |
| D. | 研发高效生物生长调节剂,减少对化肥的使用 |
分析 A.太阳能取之不尽用之不竭;
B.烃是碳、与氢原子所构成的化合物;
C.脱硫可以减少二氧化硫的排放,反应生成石膏矿;
D.高效生物生长调节剂可促进植物生长.
解答 解:A.开发光电转换材料,充分利用太阳能,是化学发展方向之一,故A正确;
B.聚氯乙烯含有氯元素,不是烃,故B错误;
C.用石灰对煤燃烧后形成的烟气脱硫,可以减少二氧化硫的排放,反应生成石膏矿,故C正确;
D.高效生物生长调节剂可促进植物生长,可减少对化肥的使用,故D正确.
故选B.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
4.下列关于乙醇和乙酸的说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 相同条件下与金属钠反应的速率,乙醇比乙酸慢 | |
| C. | 医用酒精属于混合物,醋酸是一元弱酸 | |
| D. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
5.如表是元素周期表的一部分,其中X、Y、Z、W为短周期元素,五种元素在周期表中的相对位置如图所示.已知Z元素的质子数等于X元素最外层电子数的4倍,下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | W、Z、T元素的原子半径及它们的最高价氧化的水化物的酸性均依次递增 | |
| B. | X、Y在自然界中都存在多种同素异形体,其氢化物的沸点一定是后者高 | |
| C. | ZY2、WY2可以形成同种类型的晶体,它们都有杀菌消毒的作用 | |
| D. | 根据元素周期律,可以推测Y、Z、T元素的单质与H2化合时的△H逐渐减少 |
19.下列实验操作不正确的是( )

| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
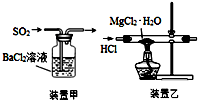
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |

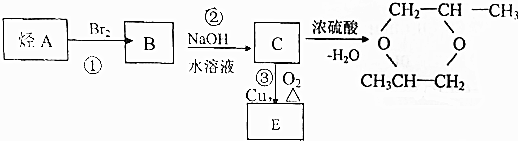
 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应. .
. )的合成路线流程(无机试剂可任选).合成路线流程图示例如下:
)的合成路线流程(无机试剂可任选).合成路线流程图示例如下: