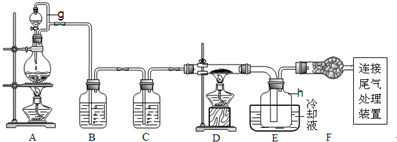
题目内容
有关电解质溶液的叙述错误的是( )
| A、向氨水中加水可使溶液中n(OH-)增大 |
| B、若Na2A、Na2B溶液的pH分别为8和9,则酸性一定是H2A>H2B |
| C、常温下,pH=2的某二元强酸和pH=12的某一元强碱溶液等体积混合,所得溶液的pH一定等于7 |
| D、0.5mol?L-1的醋酸钠溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的原理
专题:
分析:A、氨水中存在电离平衡NH3?H2O?NH4++OH-,加水促进氨水的电离,氢氧根离子物质的量增大;
B、Na2A、Na2B溶液的浓度没有说明无法判断H2A,H2B的酸性强弱;
C、强酸溶液PH=2,c(H+)=10-2mol/L,强碱溶液PH=12,c(H+)=10-12mol/L,c(OH-)=10-2mol/L,等体积混合完全反应生成强酸强碱盐;
D、钠离子不水解,醋酸根离子水解,水解后溶液呈碱性.
B、Na2A、Na2B溶液的浓度没有说明无法判断H2A,H2B的酸性强弱;
C、强酸溶液PH=2,c(H+)=10-2mol/L,强碱溶液PH=12,c(H+)=10-12mol/L,c(OH-)=10-2mol/L,等体积混合完全反应生成强酸强碱盐;
D、钠离子不水解,醋酸根离子水解,水解后溶液呈碱性.
解答:
解:A、氨水中存在电离平衡NH3?H2O?NH4++OH-,加水促进氨水的电离,氢氧根离子物质的量增大,故A正确;
B、Na2A、Na2B溶液的浓度没有说明无法判断H2A,H2B的酸性强弱,故B错误;
C、强酸溶液PH=2,c(H+)=10-2mol/L,强碱溶液PH=12,c(H+)=10-12mol/L,c(OH-)=10-2mol/L,等体积混合完全反应生成强酸强碱盐,溶液PH=7,故C正确;
D、钠离子不水解,醋酸根离子水解,水解后溶液呈碱性,溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选B.
B、Na2A、Na2B溶液的浓度没有说明无法判断H2A,H2B的酸性强弱,故B错误;
C、强酸溶液PH=2,c(H+)=10-2mol/L,强碱溶液PH=12,c(H+)=10-12mol/L,c(OH-)=10-2mol/L,等体积混合完全反应生成强酸强碱盐,溶液PH=7,故C正确;
D、钠离子不水解,醋酸根离子水解,水解后溶液呈碱性,溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选B.
点评:本题考查了电解质溶液中离子浓度大小比较,酸碱反应后的酸碱性判断,离子积常数的计算应用和溶液PH计算分析,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是( )
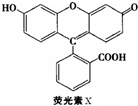

| A、荧光素的分子式为C20H14O5 |
| B、1molX最多能与9mol氢气反应 |
| C、1molX与足量的浓溴水反应,最多消耗4molBr2 |
| D、X能与甲醛发生缩聚反应 |
现向一含有Cu2+、Ca2+的混合溶液中滴入Na2CO3溶液,若首先生成CuCO3沉淀,据此可以得出的结论是( )
| A、Km(CuCO3)<Km(CaCO3) | ||||
| B、C[Cu2+]<c[Ca2+] | ||||
C、
| ||||
D、
|
在如图装置中,若通电一段时间后乙装置左侧电极增加,则下列说法中错误的是( )


| A、乙中左侧电极反应式:Cu2++2e-═Cu |
| B、电解过程中装置丙的pH无变化 |
| C、向甲中通入适量的HCI气体,可使溶液恢复到电解前的状态 |
| D、当甲装置中产生标准状况下4.48L气体时,Cu电极上质量增加43.2g |
下列说法正确的是( )
| A、1mol葡萄糖可与5mol乙醇发生酯化反应 |
| B、油脂氢化、氨基酸形成多肽、蛋白质水解都属于取代反应 |
| C、可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 |
| D、乙二醇、甲醛、α-羟基丙酸(CH3-CHOH-COOH)都可发生缩聚反应 |
常温时,下列关于电解质溶液的叙述正确的是( )
| A、物质的量相同的两种盐NaX、NaY的溶液,pH依次为9、10,则HX的酸性比HY弱 |
| B、相同体积、相同物质的量浓度的盐酸与醋酸溶液,分别与同浓度的氢氧化钠溶液恰好完全反应时,醋酸消耗的氢氧化钠溶液体积多 |
| C、pH=11的NaOH溶液和pH=11的氨水分别稀释100倍,前者pH一定小于后者 |
| D、分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |