题目内容
20.有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的$\frac{1}{2}$,乙元素原子核内无中子,丙元素原子核内有8个质子.(1)写出丙元素的元素符号O,画出丙的原子结构示意图
 ;
;(2)乙、丙两种元素形成的具有18电子的化合物是H2O2.(填化学式)
(3)写出甲、乙、丙三种元素组成的化合物在水中的电离方程式NaOH=Na++OH-.
分析 根据甲元素M层的电子数是其K层的电子数的$\frac{1}{2}$,可知甲为钠;乙元素原子核内无中子,可知乙为氢元素;丙元素原子核内有8个质子,可知丙为氧元素,然后根据题目解答.
解答 解:甲元素M层的电子数是其K层的电子数的$\frac{1}{2}$,可知甲为钠;乙元素原子核内无中子,可知乙为氢元素;丙元素原子核内有8个质子,可知丙为氧元素,
(1)丙为氧元素,元素符号为O,原子结构示意图为 ,故答案为:O;
,故答案为:O; ;
;
(2)乙为氢元素、丙为氧元素,乙、丙两种元素形成的具有18电子的化合物是H2O2,故答案为:H2O2;
(3)甲、乙、丙三种元素组成的化合物为NaOH,在水中的电离方程式为:NaOH=Na++OH-,故答案为:NaOH=Na++OH-.
点评 本题考查位置结构性质的综合应用,题目难度中等,涉及粒子核外电子排布、结构示意图、电离方程式,正确推断元素的种类为解答该题的关键,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
9.常温下,向25mL 0.1mol•L-1弱碱MOH溶液中逐滴滴加0.2mol•L-1的HCl,溶液pH的变化曲线如图所示(溶液混合时体积的变化忽略不计).下列说法正确的是( )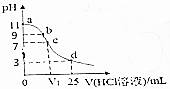

| A. | MOH电离方程式为:MOH═M++OH- | |
| B. | 在b点,离子浓度大小为c(OH-)>c(H+)>c(M+)>c(Cl-) | |
| C. | 在c点,滴加的V(HCl)>12.5mL | |
| D. | 在d点,c(Cl-)=2c(MOH)+2c(M+)=0.1mol•L-1 |
11.下列关于硅的化学性质的叙述,正确的是( )
| A. | 常温时不和任何酸反应 | B. | 常温时可和强碱溶液反应 | ||
| C. | 单质硅比碳的还原性弱 | D. | 单质硅比碳的氧化性强 |
8.t℃时某Ba(OH)2稀溶液中,c(H+)=10-xmol•L-1、c(OH-)=10-ymol•L-1,且x+y=16.向该溶液中逐滴加入pH=m的盐酸,t℃下测得混合液的pH如下表所示(假设混合时体积变化忽略不计),则m、n分别为( )
| 序号 | Ba(OH)2溶液体积/mL | 盐酸体积/mL | 混合液pH |
| 1 | 22.00 | 0 | 10 |
| 2 | 22.00 | 22.00 | 8 |
| 3 | 22.00 | 18.00 | n |
| A. | 4、9 | B. | 4、7 | C. | 6、9 | D. | 6、7 |
15.下列物质露置在空气中,质量会减轻的是( )
| A. | NaOH | B. | Na2CO3•10H2O | C. | 无水CaCl2 | D. | Na 2O2 |
5.下列电离方程式不正确的是( )
| A. | NaHCO3═Na++HCO3- | B. | NaHSO4═Na++H++SO42- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43- |
12.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2 L SO3所含的原子数为2NA | |
| B. | 标准状况下,22.4L氧气和乙炔混合物所含的分子数为NA | |
| C. | 0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA | |
| D. | 46g NO2和N2O4的混合物所含的分子数为NA |
9.下列现象与氢键有关的是( )
①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
④水分子高温下也很稳定
⑤水分子较硫化氢分子稳定.
①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
④水分子高温下也很稳定
⑤水分子较硫化氢分子稳定.
| A. | ①②③ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③④ |
10.钠和锂有相似的化学性质,下列说法中,能较好地解释这个事实的是( )
| A. | 都是金属元素 | B. | 原子半径相差不大 | ||
| C. | 最外层电子数相同 | D. | 化合价相同 |