题目内容
下列叙述中正确的是( )
| A、Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
| B、Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜 |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| D、加入铝粉能产生H2的溶液中,一定存在大量的Na+、Ba2+、AlO2-、Cl- |
考点:常见金属元素的单质及其化合物的综合应用
专题:
分析:A.氧化铝为两性氧化物;
B.Fe3+可与Cu发生氧化还原反应;
C.向NaAlO2溶液中通入过量CO2生成HCO3-;
D.加入铝粉能产生H2的溶液呈强碱性或为非氧化性酸溶液.
B.Fe3+可与Cu发生氧化还原反应;
C.向NaAlO2溶液中通入过量CO2生成HCO3-;
D.加入铝粉能产生H2的溶液呈强碱性或为非氧化性酸溶液.
解答:
解:A.氧化铝为两性氧化物,故A错误;
B.铁离子具有氧化性,能和铜发生氧化还原反应Cu+2Fe3+=Cu2++2Fe2+,生成亚铁离子和铜离子,所以氯化铁能腐蚀铜板,故B正确;
C.向NaAlO2溶液中通入过量CO2生成HCO3-,离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C错误;
D.加入铝粉能产生H2的溶液呈强碱性或为非氧化性酸溶液,碱性条件下AlO2-不能电离共存,故D错误.
故选B.
B.铁离子具有氧化性,能和铜发生氧化还原反应Cu+2Fe3+=Cu2++2Fe2+,生成亚铁离子和铜离子,所以氯化铁能腐蚀铜板,故B正确;
C.向NaAlO2溶液中通入过量CO2生成HCO3-,离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C错误;
D.加入铝粉能产生H2的溶液呈强碱性或为非氧化性酸溶液,碱性条件下AlO2-不能电离共存,故D错误.
故选B.
点评:本题综合考查元素化合物知识,为高频考点,侧重学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关知识的积累.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
某同学实际配制的NaOH溶液的浓度偏低,其原因不正确的是( )
| A、使用滤纸称量NaOH固体 |
| B、容量瓶中原来存在少量蒸馏水 |
| C、溶解后的烧杯未经洗涤 |
| D、定容时仰视刻度线 |
配制一定物质的量浓度溶液时,下列操作会使配得溶液物质的量浓度偏高的是( )
| A、没有洗涤烧杯和玻璃棒 |
| B、定容时凹液面最低点低于刻度线 |
| C、容量瓶用蒸馏水洗涤干净后没有进行干燥就移入所配制溶液 |
| D、转移过程中有少量溶液溅出 |
在一定温度下,在一个密闭容器中加入H2和I2蒸气各0.5mol,发生反应H2+I2?2HI,达到平衡时,生成HI 0.8mol,若其它条件不变,开始充入的H2为2mol,则达到平衡时生成的HI可能是下列中的( )
| A、1.1 mol |
| B、0.87 mol |
| C、0.8 mol |
| D、0.5 mol |
根据陈述的知识,类推得出的结论正确的是( )
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、已知ⅣA沸点CH4<SiH4<GeH4,则ⅤA族沸点 NH3<PH3<AsH3 |
| C、已知Fe与S直接化合生成FeS,则Cu与S直接化合生成Cu2S |
| D、已知Ca(HCO3)2+2NaOH(过量)=CaCO3↓+Na2CO3+2H2O,则Mg(HCO3)2+2NaOH(过量)=MgCO3↓+Na2CO3+2H2O |
下列说法正确的是( )
| A、从海水提取物质都必须通过化学反应才能实现 |
| B、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| C、“绿色化学”的核心是利用化学原理进行环境治理 |
| D、生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
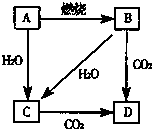 如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式:
如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式: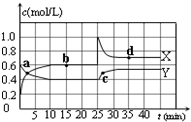 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.