题目内容
13.下表为元素周期表的一部分:| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)请画出元素⑦的原子结构示意图
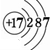 .
.(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
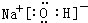 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
分析 由元素在周期表中位置,可知①为H、②为O、③为Na、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar.
(1)Cl的质子数为17,原子结构中有3个电子层,最外层电子数为7;
(2)Si的原子结构中有3个电子层,最外层电子数为4;
(3)电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小;
(4)非金属性越强,最高价氧化物对应水化物酸性越强;
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物为NaOH,与氧化铝反应生成偏铝酸钠和水.
解答 解:由元素在周期表中位置,可知①为H、②为O、③为Na、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar.
(1)Cl的质子数为17,原子结构中有3个电子层,最外层电子数为7,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)Si的原子结构中有3个电子层,最外层电子数为4,位于第三周期第 IVA族,故答案为:第三周期第 IVA族;
(3)电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小,离子半径为S2->O2->Na+,故答案为:S2->O2->Na+;
(4)非金属性Cl>S>Si,最高价氧化物对应水化物酸性为HClO4>H2SO4>H2SiO3,故答案为:HClO4>H2SO4>H2SiO3;
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物为NaOH,其电子式为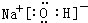 ,与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:
,与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为: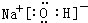 ;Al2O3+2OH-=2AlO2-+H2O.
;Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

练习册系列答案
相关题目
8.下列物质中不属于有机物的是( )
| A. | 碳酸钠(Na2CO3) | B. | 醋酸(CH3COOH) | C. | 乙炔 | D. | 四氯化碳(CCl4) |
5.取四张湿润的蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加69%的硝酸、98.3%的硫酸、新制氯水、浓氨水,四张试纸最后呈现的颜色是( )
| A. | 白、红、白、蓝 | B. | 白、白、白、蓝 | C. | 白、黑、白、蓝 | D. | 红、黑、红、蓝 |
2.合成药物异搏定路线中某一步骤如下:
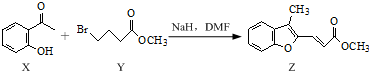
下列说法正确的是( )
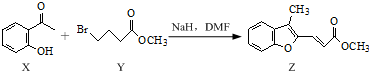
下列说法正确的是( )
| A. | 物质X在空气中不易被氧化 | |
| B. | 物质Y中只含1个手性碳原子 | |
| C. | 物质Z中所有碳原子可能在同一平面内 | |
| D. | 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2 |
3.1kg物质的量浓度为16.8mol/L,质量分数为88%的浓硫酸,与1L水混合后,得到质量分数为44%的稀硫酸,该稀硫酸的物质的量浓度可能为( )
| A. | =8.4 | B. | >8.4 | C. | <8.4 | D. | ≤8.4 |
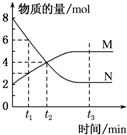 一定温度下,某容积为2L的密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示: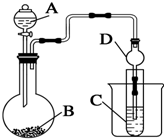 某兴趣小组设计如下实验来证明同周期元素Cl和S的非金属性强弱.
某兴趣小组设计如下实验来证明同周期元素Cl和S的非金属性强弱.