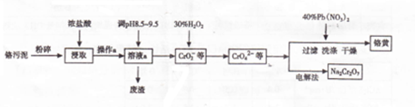
题目内容
3.1kg物质的量浓度为16.8mol/L,质量分数为88%的浓硫酸,与1L水混合后,得到质量分数为44%的稀硫酸,该稀硫酸的物质的量浓度可能为( )| A. | =8.4 | B. | >8.4 | C. | <8.4 | D. | ≤8.4 |
分析 硫酸的浓度越大,密度越大,设硫酸的密度,根据c=$\frac{1000ρω}{M}$表示出于硫酸的浓度,再结合硫酸密度判断.
解答 解:设88%硫酸的密度为ag/mL,44%硫酸的密度为bg/mol,则:$\frac{1000×a×88%}{98}$=16.8,$\frac{1000×b×44%}{98}$=c2,
故$\frac{2a}{b}$=$\frac{16.8}{{c}_{2}}$,c2=$\frac{16.8×b}{2a}$=8.4×$\frac{b}{a}$,
硫酸的浓度越大,密度越大,则a>b,
所以c2=8.4×$\frac{b}{a}$<8.4,
故选C.
点评 本题考查物质的量浓度计算,题目难度不大,明确硫酸浓度越大,密度越大为解答关键,也可以利用密度判断稀硫酸的体积大于浓硫酸体积的2倍进行解答,试题培养了学生的化学计算能力.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
13.下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的原子结构示意图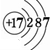 .
.
(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式: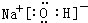 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)请画出元素⑦的原子结构示意图
 .
.(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
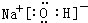 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
14.“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如下图所示.
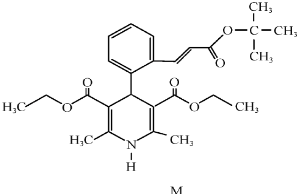
下列关于M的说法正确的是( )

下列关于M的说法正确的是( )
| A. | 属于芳香族化合物 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 1molM完全水解生成2mol醇 |
18.下列物质属于纯净物的是( )
| A. | 空气 | B. | 氨水 | C. | 磁铁矿 | D. | 冰水共存物 |
8.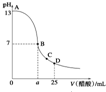 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )| A. | B点的横坐标a>12.5 | |
| B. | C点时溶液中有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| D. | 曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
12.Na[Al(OH)4]向溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是( )
| A. | HCl | B. | CO2 | C. | NH3 | D. | CO |
13.短周期元素的离子:aW3+、bX+、cY2-、dZ-具有相同的电子层结构,下列关系中不正确的是( )
| A. | 半径:Y2->Z->X+>W3+ | B. | 还原性:Y2->Z- | ||
| C. | 氧化性:W3+>X+ | D. | 质子数:c>d>b>a |
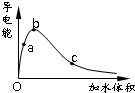 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示:
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示: