题目内容
1.NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为6、6.分析 因为Ni0的晶体结构类型与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,据此判断Ni0晶胞中Ni和O的配位数.
解答 解:由于Ni0的晶体结构类型与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6,
故答案为:6;6.
点评 本题考查晶体的结构与物质的性质的相互关系及应用,题目难度不大,明确常见晶体结构与配位数为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
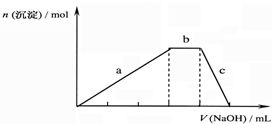
10.某反应过程能量变化如图所示,下列说法正确的是( )
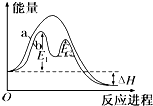

| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为吸热反应,热效应等于△H | |
| C. | 反应过程a有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
13.下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
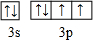
(1)请画出元素⑦的原子结构示意图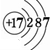 .
.
(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式: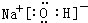 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)请画出元素⑦的原子结构示意图
 .
.(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
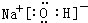 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O. 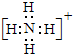
 ;
; .
.
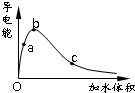 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示:
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示: