题目内容
2.用镁铝合金的废料、稀硫酸、稀盐酸、氢氧化钠溶液制取MgCl2溶液和Al2(SO4)3,若只允许通过四步反应来完成,依次写出反应的化学方程式(1)2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)Mg+2HCl═MgCl2+H2↑.
(3)2NaAlO2+2H2O+H2SO4═2Al(OH)3↓+Na2SO4.
(4)2Al(OH)3+3H2SO4═Al2(H2SO4)3+6H2O.
分析 (1)铝能溶于氢氧化钠溶液生成偏铝酸钠,镁和氢氧化钠溶液不反应;
(2)将不溶于氢氧化钠溶液的固体溶于稀盐酸制得氯化镁;
(3)偏铝酸钠和适量酸反应生成氢氧化铝;
(4)氢氧化铝和稀硫酸反应生成硫酸铝.
解答 解:(1)将合金废料溶于过量氢氧化钠溶液,铝和氢氧化钠溶液反应生成可溶性的偏铝酸钠,方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,镁和氢氧化钠溶液不反应;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(2)过滤后得到固体Mg,将沉淀溶于稀盐酸中得到氯化镁溶液,镁和盐酸反应方程式为Mg+2HCl═MgCl2+H2↑,
故答案为:Mg+2HCl═MgCl2+H2↑;
(3)滤液是偏铝酸钠的溶液,加入适量稀硫酸生成氢氧化铝沉淀,方程式为:2NaAlO2+2H2O+H2SO4═2Al(OH)3↓+Na2SO4,
故答案为:2NaAlO2+2H2O+H2SO4═2Al(OH)3↓+Na2SO4;
(4)氢氧化铝溶于稀硫酸得到硫酸铝溶液,2Al(OH)3+3H2SO4═Al2(H2SO4)3+6H2O;
故答案为:2Al(OH)3+3H2SO4═Al2(H2SO4)3+6H2O.
点评 本题以镁铝为载体考查了物质的提纯及分离,侧重于反应方程式的考查,根据物质的化学性质及溶解性采用适合的溶剂来分离物质,明确物质的性质是解题关键,注意分析问题的缜密性、操作方法的规范性,难度中等.

练习册系列答案
相关题目
13.下列“类推”合理的是( )
| A. | 加热CS2CO3可生成CS2O和CO2(CS:铯 IA) | |
| B. | 铊(Tl)与铝同族,其单质既能与HCl又能与NaOH溶液反应 | |
| C. | AgAt为白色沉淀,不溶于稀HNO3(At:砹 VⅡA) | |
| D. | Ra(OH)2是易溶于水的强碱(Ra:镭ⅡA) |
10.某反应过程能量变化如图所示,下列说法正确的是( )
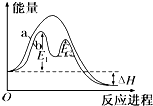

| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为吸热反应,热效应等于△H | |
| C. | 反应过程a有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
7.已知酸性强弱顺序为H2CO3>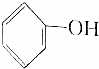 >HCO3-,下列化学方程式不正确的是( )
>HCO3-,下列化学方程式不正确的是( )
 >HCO3-,下列化学方程式不正确的是( )
>HCO3-,下列化学方程式不正确的是( )| A. | 2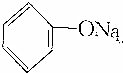 +H2O+CO2→2 +H2O+CO2→2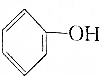 +Na2CO3 +Na2CO3 | B. | 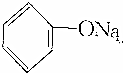 +H2O+CO2→ +H2O+CO2→ +NaHCO3 +NaHCO3 | ||
| C. |  +Na2CO3→ +Na2CO3→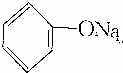 +NaHCO3 +NaHCO3 | D. | 2 +2Na→2 +2Na→2 +H2↑ +H2↑ |
14.下列实验操作和结论错误的是( )
| A. | 用新制Cu(OH)2可鉴别麦芽糖和蔗糖 | |
| B. | 用银镜反应可证明淀粉是否转化为葡萄糖,但不能证明是否完全转化 | |
| C. | 浓H2SO4可使蔗糖脱水变黑,证明蔗糖含C,H,O三种元素 | |
| D. | 蔗糖溶液中滴加几滴稀H2SO4后,水溶加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
13.下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的原子结构示意图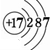 .
.
(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式: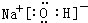 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)请画出元素⑦的原子结构示意图
 .
.(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
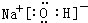 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O. 
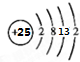 ,其最高正价为+7;位于元素周期表中第四周期ⅦB族.
,其最高正价为+7;位于元素周期表中第四周期ⅦB族.