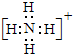题目内容
18.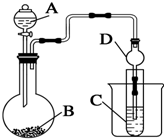 某兴趣小组设计如下实验来证明同周期元素Cl和S的非金属性强弱.
某兴趣小组设计如下实验来证明同周期元素Cl和S的非金属性强弱.(可供选择的试剂有:KMnO4固体、MnO2固体、浓盐酸、Na2S溶液 )
(1)仪器A的名称为分液漏斗;干燥管D的作用是防倒吸;装置B中所装药品为高锰酸钾固体;
(2)C中溶液的现象为产生淡黄色沉淀;
(3)烧瓶中发生反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
分析 (1)A仪器名称是分液漏斗;元素的非金属性越强,其单质的氧化性越强,要证明Cl、S原子非金属性强弱,只要氯气能置换出硫化钠中的S即可,要用高锰酸钾和浓盐酸制取氯气,然后将氯气和硫化钠溶液混合观察现象;
(2)S是不易溶于水的淡黄色固体;
(3)高锰酸钾和浓盐酸发生氧化还原反应生成氯化锰、氯化钾、氯气和水.
解答 解:(1)A仪器名称是分液漏斗;元素的非金属性越强,其单质的氧化性越强,要证明Cl、S原子非金属性强弱,只要氯气能置换出硫化钠中的S即可,要用高锰酸钾和浓盐酸制取氯气,然后将氯气和硫化钠溶液混合观察现象,氯气极易和硫化钠溶液反应而产生倒吸,所以D装置能防止倒吸,B中药品是高锰酸钾固体,故答案为:分液漏斗;防倒吸;高锰酸钾固体;
(2)氯气和硫化钠发生氧化还原反应生成难溶于水的S淡黄色沉淀,所以看到的现象是C溶液中产生淡黄色沉淀,故答案为:产生淡黄色沉淀;
(3)高锰酸钾和浓盐酸发生氧化还原反应生成氯化锰、氯化钾、氯气和水,反应方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,故答案为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
.
点评 本题考查性质实验方案设计,为高频考点,明确实验原理及物质性质是解本题关键,侧重考查学生对知识的综合应用能力,知道常见仪器的用途,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
7.已知酸性强弱顺序为H2CO3>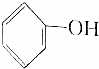 >HCO3-,下列化学方程式不正确的是( )
>HCO3-,下列化学方程式不正确的是( )
 >HCO3-,下列化学方程式不正确的是( )
>HCO3-,下列化学方程式不正确的是( )| A. | 2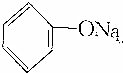 +H2O+CO2→2 +H2O+CO2→2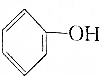 +Na2CO3 +Na2CO3 | B. | 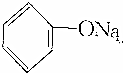 +H2O+CO2→ +H2O+CO2→ +NaHCO3 +NaHCO3 | ||
| C. |  +Na2CO3→ +Na2CO3→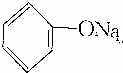 +NaHCO3 +NaHCO3 | D. | 2 +2Na→2 +2Na→2 +H2↑ +H2↑ |
13.下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的原子结构示意图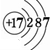 .
.
(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式: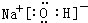 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)请画出元素⑦的原子结构示意图
 .
.(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
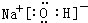 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
3.下列说法正确的是( )
| A. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| B. | 分子式为C5H12O且氧化产物能发生银镜反应的醇有6种 | |
| C. | 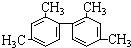 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 1mol β-紫罗兰酮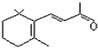 与1mol H2发生加成反应可得到3种不同产物 与1mol H2发生加成反应可得到3种不同产物 |
7.已知各破坏1mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.计算1mol N2(g)和3mol H2(g)完全转化为NH3(g)的能量变化为( )
| A. | 吸收92KJ | B. | 放出92kJ | C. | 吸收184kJ | D. | 放出184KJ |
8.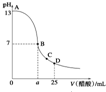 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )| A. | B点的横坐标a>12.5 | |
| B. | C点时溶液中有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| D. | 曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |