题目内容
18.1862年比利时化学家索尔维以NaCl、CO2、NH3、H2O为主要原料,制得纯净碳酸钠,称之为索尔维制碱法.索尔维制碱法的主要操作程序是:①在饱和食盐水中通入氨气氨化后,再通入二氧化碳,析出碳酸氢钠晶体;
②将碳酸氢钠固体在250℃焙烧以制得碳酸钠,生成的二氧化碳可循环使用;
③在分离出碳酸氢钠固体的母液里,加入生石灰加入,使氨逸出,并循环使用.
阅读以上材料,回答以下各问:
(1)饱和食盐水要先氨化后,再通入二氧化碳,在这个生成NaHCO3过程中,发生的两步化学方程式是CO2+NH3+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl.
(2)在析出NaHCO3晶体的母液中,加入生石灰并加热时,发生反应的化学方程式是CaO+H2O=Ca(OH)2、NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O、2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)把NaHCO3变为Na2CO3的化学方程式是2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑.
(4)我国化学家侯德榜提出了将索尔维制碱与合成氨联合生产,创立了全新的现代制碱工艺,被世界化学界称为侯氏制碱法.
侯氏制碱法的主要特点是:用合成氨厂生产的NH3及CO2为原料,在析出NaHCO3晶体的母液里,加入食盐,使氯化铵晶体析出,饱和食盐水循环使用.
阅读以上材料,简析侯氏制碱法的优点:使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用.
分析 (1)氨气溶液水生成一水合氨,二氧化碳与一水合氨反应生成碳酸氢铵,氯化钠与碳酸氢铵反应生成氯化铵和碳酸氢钠;
(2)析出小苏打的母液中含有氯化铵,加入生石灰后,生石灰与水反应生成氢氧化钙,氢氧化钙与氯化铵反应生成氨气;
(3)碳酸氢钠不稳定,受热分解生成碳酸钠、水和二氧化碳;
(4)分析比较两种制备流程,结合反应生成产物比较异同,从副产物的主要作用和原料利用等分析比较.
解答 解:(1)氨化的饱和NaCI溶液中通过入CO2,反应生成碳酸氢钠和氯化铵,方程式为:CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
故答案为:CO2+NH3+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
(2)析出小苏打的母液中含有氯化铵和碳酸氢钠,加入生石灰后,生石灰与水反应生成氢氧化钙,碳酸氢钠溶液与氢氧化钙反应生成碳酸钙沉淀,氢氧化钙与氯化铵反应生成氨气,发生的化学方程式为:CaO+H2O=Ca(OH)2、NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O、2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:CaO+H2O=Ca(OH)2、NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O、2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)碳酸氢钠受热分解的化学方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)索尔维法缺点:大量CaCl2用途不大,NaCl利用率只有70%,约有30%的NaCl留在母液中;
侯氏制碱法的优点:把合成氨和纯碱两种产品联合生产,提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本.保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96%;NH4Cl可做氮肥;可与合成氨厂联合,使合成氨的原料气CO转化成CO2,减少无用的氯化钙生成;
故答案为:使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用.
点评 本题考查了纯碱的制备原理分析比较,明确物质的性质和生产原理是解题关键,题目难度中等.

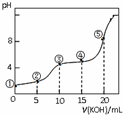 常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )| A. | 点②溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| B. | 点③溶液中:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) | |
| C. | 点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05 mol•L-1 | |
| D. | 点⑤溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
| A. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+═I2+O2↑+2H2O | |
| C. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至PH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用碳酸钠溶液浸泡锅炉水垢:Ca2++CO32-═CaCO3↓ |
①2NO2?N2O4 (正反应为放热反应)
②C(s)+CO2?2CO (正反应为吸热反应)
③N2+3H2?2NH3 (正反应为放热反应)
④H2S?H2+S(s)(正反应为吸热反应)
| A. | ①③ | B. | ② | C. | ①② | D. | ②③ |
(1)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1
则表示CH3OH蒸汽燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1.
(2)在一定温度下,按下表中的物质的量投入容积为2L的恒容密闭容器中,发生反应:CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1,得到如下数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
②750℃,该反应的平衡常数K=1.56(保留两位小数)
③已知750℃时,若实验4在体积可变的恒压密闭容器中反应,达到平衡时CO的体积分数为W%,相同条件下,若起始时容器中加入xmolCO、ymolH2和0.4molCH3OH气体,达到平衡时,欲保持CO的体积分数仍为W%,则x、y应满足的条件是x:y=1:2(用含x、y的式子表示).
(3)利用甲醇通过如图装置电解精炼铜,请回答下列问题:
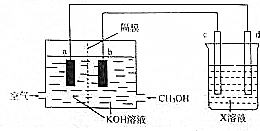
①应选粗铜作d电极的电极材料,C电极的名称为阴极,X溶液为硫酸铜溶液;
②b电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
③电解精炼过程中a电极附近溶液的pH会增大(填“增大”、“减小”或“不变”)
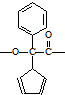
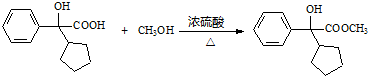 .
.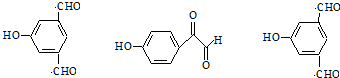 .
.