题目内容
10.下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )①2NO2?N2O4 (正反应为放热反应)
②C(s)+CO2?2CO (正反应为吸热反应)
③N2+3H2?2NH3 (正反应为放热反应)
④H2S?H2+S(s)(正反应为吸热反应)
| A. | ①③ | B. | ② | C. | ①② | D. | ②③ |
分析 根据化学平衡移动原理:增大压强,化学平衡向着气体体积减小的方向进行;升高温度,化学平衡向着吸热方向进行,据此结合选项解答.
解答 解:①正反应为体积减小的反应,增大压强,平衡正向移动,正反应是放热反应,降低温度平衡正向移动,故①不符合;
②正反应为体积增大的反应,增大压强,平衡逆向移动,正反应是吸热反应,降低温度平衡逆向移动,故②符合;
③正反应为体积减小的反应,增大压强,平衡正向移动,正反应是放热反应,降低温度平衡正向移动,故③不符合;
④反应前后体积不变,增大压强平衡不移动,正反应是吸热反应,降低温度平衡逆向移动,故④不符合;
故选B.
点评 本题考查温度和压强对化学平衡移动的影响,注意根据反应特征利用平衡移动原理解答,难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
5.在某中学的化学实验室药品柜中,有一个装有Na2O2试剂的铁罐,使用多年,锈迹斑斑,瓶内有白色固体,并伴有结块.
(1)围绕上述事实,结合你的化学实践经验,提出一个有价值的探究课题(或问题)探究试剂是否变质.
(2)某化学兴趣小组从瓶内固体的颜色初步判断,该试剂已经变质,理由是瓶内有白色固体,而Na2O2为淡黄色固体.
(3)在完成上述定性判断后,兴趣小组采用了下列两种方法进行定量研究──测 定样品中Na2O2的含量.
定样品中Na2O2的含量.
方法1──量气法
通过测量Na2O2与水反应放出O2的体积,计算样品中Na2O2的含量.
测量工具为1个胶塞和1个注射器 (可灵活装卸活塞、气密性良好).实验流程图如下:

(“估算”是指根据注射器容积确定m样品的最大值;忽略固体样品的体积)
请根据上述实验流程图,写出 A、C的实验操作并完善B的操作步骤:
A:称量;B:吸水,用胶塞迅速堵住针头;C:读数.
方法2--蒸发法
假设样品中含钠元素的物质只有Na2O2和Na2CO3,实验过程如图:
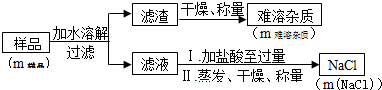
①上述实验步骤中,需要用到玻璃棒的操作是溶解、过滤或蒸发(填两种操作方法).
②往滤液中加稀盐酸至过量,其目的是使滤液中的NaOH、Na2CO3(填化学式)完全转化为NaCl.
③实验结束后,往难溶杂质中滴加稀盐酸,发现其溶解,所得溶液呈黄色,说明样品中的难溶杂质为Fe2O3.
④该小织实验数据记录如表:
根据上述数据计算,Na2O2的质量分数为66.3%.
(4)上述两种测定Na2O2含量的方法中,方法1(填“1”或“2”)的测量结果更准确.
(1)围绕上述事实,结合你的化学实践经验,提出一个有价值的探究课题(或问题)探究试剂是否变质.
(2)某化学兴趣小组从瓶内固体的颜色初步判断,该试剂已经变质,理由是瓶内有白色固体,而Na2O2为淡黄色固体.
(3)在完成上述定性判断后,兴趣小组采用了下列两种方法进行定量研究──测
 定样品中Na2O2的含量.
定样品中Na2O2的含量.方法1──量气法
通过测量Na2O2与水反应放出O2的体积,计算样品中Na2O2的含量.
测量工具为1个胶塞和1个注射器 (可灵活装卸活塞、气密性良好).实验流程图如下:

(“估算”是指根据注射器容积确定m样品的最大值;忽略固体样品的体积)
请根据上述实验流程图,写出 A、C的实验操作并完善B的操作步骤:
A:称量;B:吸水,用胶塞迅速堵住针头;C:读数.
方法2--蒸发法
假设样品中含钠元素的物质只有Na2O2和Na2CO3,实验过程如图:

①上述实验步骤中,需要用到玻璃棒的操作是溶解、过滤或蒸发(填两种操作方法).
②往滤液中加稀盐酸至过量,其目的是使滤液中的NaOH、Na2CO3(填化学式)完全转化为NaCl.
③实验结束后,往难溶杂质中滴加稀盐酸,发现其溶解,所得溶液呈黄色,说明样品中的难溶杂质为Fe2O3.
④该小织实验数据记录如表:
| m样品 | m难溶杂质 | m(NaCl) |
| 8.00g | 0.42g | 10.53g |
(4)上述两种测定Na2O2含量的方法中,方法1(填“1”或“2”)的测量结果更准确.
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 L 0.1 mol•L-1的CuCl2溶液中含Cu2+为0.1NA | |
| B. | 标准状况下,22.4 L CCl4含CCl4分子为NA | |
| C. | 1mol H3O+含质子数为10 NA | |
| D. | 1mol Na2O2混合物中含阴离子的数目为NA |
20.下列有关试剂的保存方法,错误的是( )
| A. | 浓硝酸保存在棕色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 新制的氯水通常保存在棕色玻璃试剂瓶中 | |
| D. | 氢氧化钠溶液用带磨口玻璃塞的普通试剂瓶贮存 |