题目内容
6.双氧水和水都可看成是极弱的电解质,但H2O2与H2O相比,H2O2显弱酸性.(1)若把H2O2看成二元弱酸,试写出它在水中的电离方程式H2O2?H++HO2-、HO2-?H++O22-.
(2)水电离生成H3O+和OH-叫做水的自偶电离,同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为H2O2+H2O2?H3O2++HO2-..
分析 (1)过氧化氢是弱电解质属于二元弱酸分部电离;
(2)根据水的自偶电离可知,H2O2自偶电离生成H3O2+和HO2-.
解答 解:(1)过氧化氢是弱电解质,H2O2溶液显酸性属于二元弱酸分部电离,电离的方程式为:H2O2?H++HO2-、HO2-?H++O22-,
故答案为:H2O2?H++HO2-、HO2-?H++O22-;
(2)水电离生成H3O+和OH-叫做水的自偶电离,同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式:H2O2+H2O2?H3O2++HO2-,
故答案为:H2O2+H2O2?H3O2++HO2-.
点评 本题考查了弱电解质的电离方程式的书写,题目较简单,注意多元弱酸分步电离,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
14.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
| A. | 其溶液中的c(OH-)=0.1mol•L-1 | |
| B. | 加水稀释后,水电离出的c(OH-)变大 | |
| C. | 加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| D. | 与AlCl3溶液发生反应的离子方程式为:Al3++3OH-═Al(OH)3↓ |
11. 某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要500mL容量瓶.
(2)滴定:
Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号)Ⅰ.该错误操作会导致测定结果偏大(填“偏大”、“偏小”或“无影响”).
②排去碱式滴定管中气泡的方法应采用右图的丙操作.
③步骤Ⅳ中滴定时眼睛应观察锥形瓶中溶液颜色的变化;判断滴定终点的现象是当滴加最后一滴标准液时,待测液由红色刚好变为无色,且半分钟内不变色.
④若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果偏小(填“偏大”、“偏小”或“无影响”)
(3)按正确操作测得有关数据记录如下:按正确操作测得有关数据记录如表:
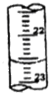
①a的读数如图所示,则a=22.60; ②烧碱样品的纯度为80.8%
 某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要500mL容量瓶.
(2)滴定:
Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号)Ⅰ.该错误操作会导致测定结果偏大(填“偏大”、“偏小”或“无影响”).
②排去碱式滴定管中气泡的方法应采用右图的丙操作.
③步骤Ⅳ中滴定时眼睛应观察锥形瓶中溶液颜色的变化;判断滴定终点的现象是当滴加最后一滴标准液时,待测液由红色刚好变为无色,且半分钟内不变色.
④若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果偏小(填“偏大”、“偏小”或“无影响”)
(3)按正确操作测得有关数据记录如下:按正确操作测得有关数据记录如表:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
15.体积和pH值都相同的HCl和CH3OOH分别与足量NaHCO3反应,产生CO2的质量( )
| A. | 同样多 | B. | HCl最多 | C. | 醋酸最多 | D. | 无法判断 |
