题目内容
1.实验室用氯化钠固体配制1.00mol•L-1的NaCl溶液500mL,回答下列问题(1)请写出该实验的实验步骤
①计算,②称量,③溶解,④移液,⑤洗涤⑥定容,⑦摇匀.
(2)所需仪器为:容量瓶(规格:500mL)、托盘天平,胶头滴管还需要那些玻璃仪器才能完成该实验,请写出烧杯,玻璃棒,胶头滴管
(3)试分析下列操作对所配溶液的浓度有何影响.、(填空:A---偏高、B---偏低、C---无影响,填序号)
①为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容.对所配溶液浓度的影响:A
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响.
③配制前容量瓶用水洗涤后未进行干燥处理C.
分析 (1)依据用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀分析;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来分析解答;
(3)具体分析操作对溶质的物质的量及溶液体积的影响,根据c=$\frac{n}{v}$判断误差;
①未降至室温时,立即将溶液转移至容量瓶定容.溶液热胀冷缩,冷却后溶液体积小于500ml;
②盖倒转摇匀后,发现溶面低于刻度线,一部分溶液留在瓶塞与瓶口之间,又滴加蒸馏水至刻度,使溶液体积大于500ml;
③配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变.
解答 解:(1)配制1.00mol/L的NaCl溶液500mL,操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,
故答案为:②称量,④移液;
(2)用氯化钠固体配制1.00mol•L-1的NaCl溶液500mL,操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,冷却后转移到500ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500ml容量瓶、胶头滴管,故还需要500ml容量瓶、烧杯、玻璃棒、胶头滴管完成该实验,
故答案为:500mL; 烧杯、玻璃棒;
(3)①(3)①未降至室温时,立即将溶液转移至容量瓶定容.溶液热胀冷缩,恢复到室温后溶液体积小于500ml,浓度偏高
故答案为:A;
②盖倒转摇匀后,发现溶面低于刻度线,一部分溶液留在瓶塞与瓶口之间,又滴加蒸馏水至刻度,使溶液体积大于500ml,溶液浓度偏低.
故答案为:B;
③配制前容量瓶用水洗涤后未进行干燥处理,对溶质的物质的量、最终溶液的体积都无影响,所以不影响溶液浓度,
故答案为:C.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理和实验步骤是解题关键,题目难度不大,试题培养了学生的分析能力及化学检验能力.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案(1)选择仪器。完成本实验所必需的仪器有:托盘天平 药匙、烧杯、玻璃棒、____________、____________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体____________g。
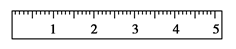
(3)称量。天平调平之后,应将天平的游码调至某个位置,请在下图中用一根 竖线标出游码左边缘所处的位置:
(4)将药品倒入烧杯中溶解、冷却。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次是为了_____________
(6)定容、摇匀。
(7)将配好的溶液倒入指定的试剂瓶,并贴好标签,注明溶液名称及浓度。
(8)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出 | B.容量瓶用蒸馏水洗净后未干燥 |
C.定容时俯视读取刻度 | D.定容时液面超过了刻度线 |
E.称量NaCl时用了生锈的砝码
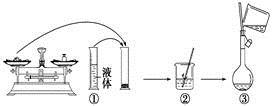
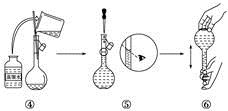
(9)下图是某同学在实验室配制该NaCl溶液的过程示意图,其中有错误的是_________(填操作序号)。
①亚硫酸溶液 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡
⑥氨气 ⑦冰醋酸 ⑧硫酸氢钠固体 ⑨氢氧化铁 ⑩NO2
(2)写出下列物质在水中的电离方程式
亚硫酸:H2SO3?H++HSO3-;次氯酸钠:NaClO═ClO-+Na+;
(3)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲:c(OH-)乙小于10(填“大于”、“等于”或“小于”).
(4)下表数据均在相同温度下测得,由此可知三种酸的酸性由强到弱的顺序为HZ>HY>HX
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
①混合气体的颜色不再改变的状态 ②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态 ④混合气体的平均相对分子质量不再改变的状态
⑤$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$的比值不再改变的状态.
①c(NH3•H2O)=1×10-3 mol•L-1的氨水b L,
②c(OH-)=1×10-3 mol•L-1的氨水c L,
③c(OH-)=1×10-3 mol•L-1的Ba(OH)2溶液d L.
试判断a、b、c、d的数量大小关系为( )
| A. | a=b>c>d | B. | b>a=d>c | C. | b>a>d>c | D. | c>a=d>b |
| A. | Fe2O3是氧化剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 生成1mol Na2FeO4时,有3mol电子转移 | |
| D. | Na2FeO4能杀菌消毒是利用Na2FeO4中+6价铁的强还原性被还原为Fe3+,净水是利用Fe3+在水中产生Fe(OH)3胶体从而吸附水中的悬浮颗粒 |
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: