��Ŀ����
17��ʵ������18.4mol/L��Ũ����������480mL 0.2mol/L��ϡ���ᣮ��1�����貣���������˲��������ձ��⣬����500mL����ƿ����ͷ�ιܡ���Ͳ��
��2��������ȡŨ��������Ϊ5.4mL��
��3�����в����������Ƶ�ϡ����Ũ���к�Ӱ�죿���á�ƫ�ߡ���ƫ�͡�����Ӱ�족��գ�
A������Ͳ��ȡŨ����ʱ��ϴ����Ͳ��ϴ��Һת�Ƶ�С�ձ���ƫ�ߣ�
B������ʱ���ӿ̶���ƫ�ͣ�
���� ��1����������һ�����ʵ���Ũ�ȵ�ʵ�鲽��ѡ����ʵ�������
��2��������Һϡ��ǰ�����ʵ����ʵ��������������Ũ�����������ݴ�ѡ����ʵ���Ͳ��
��3�������������������ʵ����ʵ���Ũ�Ⱥ���Һ�������Ӱ�죬����C=$\frac{n}{V}$������������
��� �⣺��1����Ũ��Һ����ϡ��Һһ�㲽�裺��ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ������Ͳ��ȡһ�������Ũ��Һ��Ȼ�����ձ���ϡ�ͣ���ȴ��ת�Ƶ�480mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�
�ʴ�Ϊ��500mL����ƿ����ͷ�ιܡ���Ͳ��
��2������ҪŨ��������ΪV��������Һϡ��ǰ�����ʵ����ʵ�������ã�0.2mol/L��0.5L=18.4mol/L��V��V=0.0054L=5.4mL��
�ʴ�Ϊ��5.4��
��3������C=$\frac{n}{V}$������������
A������Ͳ��ȡŨ����ʱ��ϴ����Ͳ��ϴ��Һת�Ƶ�С�ձ��У���ʹ�������ʵ����ʵ���ƫ�࣬Ũ��ƫ�ߣ�
B������ʱ�����ӿ̶��ߣ�������Һ�����ƫ����Һ��Ũ��ƫ�ͣ�
�ʴ�Ϊ��ƫ�ߣ�ƫ�ͣ�
���� ���⿼����һ�����ʵ���Ũ����Һ�����Ƽ�����������Ϥ����ԭ�����̼��ɽ����Ŀ�ѶȲ���

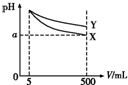 ��5 mL pH=11��X��Y���ּ�ֱ�ϡ����500 mL����pH����Һ�����V���Ĺ�ϵ��ͼ������˵����ȷ���ǣ�������
��5 mL pH=11��X��Y���ּ�ֱ�ϡ����500 mL����pH����Һ�����V���Ĺ�ϵ��ͼ������˵����ȷ���ǣ�������| A�� | ��X��Y���������a��ֵһ������9 | |
| B�� | ��ȫ�к�X��Y����Һʱ������ͬŨ��ϡ��������V��X����V��Y�� | |
| C�� | ϡ�ͺ�X��Һ��ˮ�ĵ���̶ȱ�Y��Һ��ˮ�ĵ���̶�С | |
| D�� | ��X��Y��һԪ�������ʵ���Ũ�ȵ�Y����������Һ��pH��X����������Һ�� |
| A�� | ������ˮ��ʹ����ʯ����ֽ�ȱ�죬����ɫ | |
| B�� | ������ˮ��ֻ����Cl2��H2O���� | |
| C�� | ��ˮ���������������ǿ | |
| D�� | ������ˮ�������ݳ�����������Cl2 |
| A�� | c��H+��+c��NH4+��=2c��OH-�� | |
| B�� | ��H2O�������c��H+��=1.0��10-12mol•L-1 | |
| C�� | ��������Ũ�ȵ��Ȼ����Һ���c��NH4+��+c��NH3•H2O��=0.02 mol•L-1 | |
| D�� | ��������Ũ�ȵ������Ϻ�������Һc��OH-��+c��NH3•H2O��=c��H+�� |
 ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£�
ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£�