题目内容
17.下列物质分子的电子式正确的是( )| A. | CH3Cl  | B. | 羟基 | C. | CO2  | D. | C2H4  |
分析 A、CH3Cl分子中碳原子最外层有4个电子,能形成4个共价键达到稳定结构,每个氢原子或氯原子能形成一个共价键达到稳定结构;
B、-OH中的O原子上有一个未成对电子;
C、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
D、乙烯中碳原子间以碳碳双键结合.
解答 解:A、CH3Cl分子中碳原子最外层有4个电子,能形成4个共价键达到稳定结构,每个氢原子或氯原子能形成一个共价键达到稳定结构,电子式: ,故A错误;
,故A错误;
B、-OH中的O原子上有一个未成对电子,其中氧原子和H原子以一对共用电子对结合,故电子式为 ,故B错误;
,故B错误;
C、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C错误;
,故C错误;
D、乙烯中碳原子间以碳碳双键结合,即碳原子间有两对共用电子对,故电子式为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了常见化合物和官能团的电子式的书写,应注意的是-OH不带电荷,O原子上有一个未成对电子.

练习册系列答案
相关题目
7. 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:
(1)E元素在元素周期表的位置是第三周期VIA族,C为氯(填元素名称).
(2)B的最高价氧化物与硝酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O
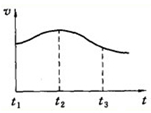
(3)某学生做A与盐酸反应的实验,去除表面的氧化镁等杂质,反应过程中感觉试管外壁发烫,试说明原因镁与盐酸的反应是放热反应,1gA完全反应放出热量为QKJ,则该反应的热化学方程式为Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1该学生通过实验测得A与盐酸反应产生气体的速率(v):与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因:镁与盐酸反应放热,温度升高反应速率加快.
 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.099 | 0.074 | 0.102 |
| 常见化合价 | +2 | +3 | -1 | -2 | +6,-2 |
(2)B的最高价氧化物与硝酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O
(3)某学生做A与盐酸反应的实验,去除表面的氧化镁等杂质,反应过程中感觉试管外壁发烫,试说明原因镁与盐酸的反应是放热反应,1gA完全反应放出热量为QKJ,则该反应的热化学方程式为Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1该学生通过实验测得A与盐酸反应产生气体的速率(v):与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因:镁与盐酸反应放热,温度升高反应速率加快.
8.化学能与热能、电能等可以相互转化,关于化学能与其它能量相互转化的说法正确的是( )

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 图II所示的反应为吸热反应 | |
| C. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
5.下列各组中的两种物质作用时,反应条件或反应物的用量改变时,对生成物没有影响的是( )
| A. | Na与O2 | B. | NaOH与CO2 | C. | Ca(OH)2与NaHCO3 | D. | Na2O2 与CO2 |
12.把下列四种 X 溶液,分别加入四个盛有 10mL 2mol/L 盐酸的烧杯中,均加水稀释到 50mL,此时 X 与盐酸和缓地进行反应.其中反应速率最大的是( )
| A. | 20mL3mol/L 的 X 溶液 | B. | 20mL2mol/L 的 X 溶液 | ||
| C. | 10mL4mol/L 的 X 溶液 | D. | 10mL2mol/L 的 X 溶液 |
9.(1)用正确的序号填空:①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是①; 互为同素异形体的是②;
互为同分异构体的是④; 互为同系物的是⑤
(2)由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
互为同位素的是①; 互为同素异形体的是②;
互为同分异构体的是④; 互为同系物的是⑤
(2)由A、B、C、D四种金属按下表中装置进行实验.
| 装置 |  |  |  |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
6.从下列元素中:H、O、N、Si、S、Mg选出其中的一种或几种,组成典型的四类晶体,要求:每种元素只能出现一次;所填物质必须能够回答问题(2)和(3):
(1)填充下表:
(2)构成晶体B的基态原子的电子排布式为1s22s22p63s23p2,
D中原子采取的堆积方式为A3最密堆积.
(3)将晶体A溶于水,在所得的溶液中加入足量的盐酸,写出该反应的离子方程式2H++S2-=H2S↑.
(1)填充下表:
| 物质代号 | A | B | C | D |
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 | 金属晶体 |
| 相应的化学式 |
D中原子采取的堆积方式为A3最密堆积.
(3)将晶体A溶于水,在所得的溶液中加入足量的盐酸,写出该反应的离子方程式2H++S2-=H2S↑.
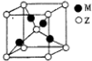 X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,
X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,