题目内容
17.几种短周期元素的原子半径及主要化合价如下表:| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径/(10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | 由元素X和Q组成的化合物不可能含有共价键 | |
| B. | X、Z、R的最高价氧化物对应水化物可彼此反应 | |
| C. | Y-半径比Q2-半径大 | |
| D. | M(OH)2的碱性比XOH的碱性弱 |
分析 短周期元素中,Y有+7、-1价,则Y为Cl;Q有最高价+6、最低价-2,则Q为O元素;R有+5、-3价,处于VA族,原子半径小于Cl,则R为N元素;X、M、Z的最高正化合价分别为+1、+2、+3,则分别处于IA、ⅡA、ⅢA族,原子半径X>M>Z>Cl,则X为Na、M为Mg、Z为Al.
解答 解:短周期元素中,Y有+7、-1价,则Y为Cl;Q有最高价+6、最低价-2,则Q为O元素;R有+5、-3价,处于VA族,原子半径小于Cl,则R为N元素;X、M、Z的最高正化合价分别为+1、+2、+3,则分别处于IA、ⅡA、ⅢA族,原子半径X>M>Z>Cl,则X为Na、M为Mg、Z为Al.
A.由元素X和Q组成的化合物为Na2O、Na2O2,Na2O2中含有共价键,故A错误;
B.X、Z、R的最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝、硝酸,氢氧化钠与硝酸发生中和反应,氢氧化铝属于两性氢氧化物,能与氢氧化钠及硝酸反应,故B正确;
C.离子电子层越多离子半径越大,Cl-半径比S2-半径大,故C正确;
D.金属性Mg<Na,则Mg(OH)2的碱性比NaOH的碱性弱,故D正确,
故选:A.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子半径推断元素,熟练掌握元素周期律,难度中等.

练习册系列答案
相关题目
7.下列叙述正确的是( )
| A. | 0.1mol/L醋酸溶液中:c(H+)=c(CH3COO- )+c(OH- ) | |
| B. | 中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 | |
| C. | 由水电离的H+浓度为1.0×10-4mol/L的溶液,pH一定等于4 | |
| D. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
8.下列事实能说明金属性钠比铝强的是( )
| A. | 钠能与冷水剧烈反应,而铝不能与冷水反应 | |
| B. | NaOH易溶于水,Al(OH)3难溶于水 | |
| C. | 等物质的量的NaOH和Al(OH)3,Al(OH)3可以电离出更多OH- | |
| D. | 等物质的量铝比钠失去电子数多 |
5.下列关于0.10mol•L-1 NaHCO3溶液的说法不正确的是( )
| A. | 该溶液中离子浓度关系为:c (Na+)>c(HCO3-)>c (OH-)>c(H+) | |
| B. | 25℃时,加水稀释后,$\frac{c(O{H}^{-})}{c({H}^{+})}$变小 | |
| C. | 温度升高,c(OH-)×c(H+)不变(忽略体积变化) | |
| D. | 溶液中c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
9.实验室有两瓶失去标签的溶液,其中一瓶是K2SO4溶液,另一瓶是NaOH溶液.鉴别时,下列选用的试纸或试剂不正确的是( )
| A. | pH试纸 | B. | 紫色石蕊试液 | C. | Na2CO3固体 | D. | CuCl2溶液 |
6.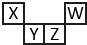 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )| A. | 最高正化合价:X<Y<Z | |
| B. | 原子半径:X<Y<Z | |
| C. | 气态氢化物的热稳定性:Z<W | |
| D. | 最高价氧化物对应水化物的酸性:X<Z |
4.下列气体的实验室制法正确的是( )
| A. | Cl2:电解饱和食盐水 | B. | O2:过氧化氢与二氧化锰混合 | ||
| C. | H2:锌粒和稀硝酸混合 | D. | NH3:氮气和氢气混合 |