题目内容
7.下列叙述正确的是( )| A. | 0.1mol/L醋酸溶液中:c(H+)=c(CH3COO- )+c(OH- ) | |
| B. | 中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 | |
| C. | 由水电离的H+浓度为1.0×10-4mol/L的溶液,pH一定等于4 | |
| D. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
分析 A、溶液显电中性;
B、醋酸是弱电解质,在溶液中不能完全电离;
C、由水电离的H+浓度为1.0×10-4mol/L的溶液,水的电离被抑制,可能是酸或碱;
D、碳酸氢钠溶液中碳酸氢根离子水解大于电离.
解答 解:A、依据电荷守恒分析,醋酸溶液中存在:c(H+)=c(CH3COO-)+c(OH-),故A正确;
B、醋酸溶液中存在电离平衡,pH与体积都相同的硫酸溶液和醋酸中,醋酸平衡状态下的氢离子和硫酸溶液中氢离子相同,完全反应后,醋酸又电离出氢离子,中和pH与体积都相同的硫酸和醋酸,消耗氢氧化钠的量前者小于后者,故B错误;
C、由水电离的H+浓度为1.0×10-4mol/L的溶液,水的电离被抑制,可能是酸或碱,故溶液PH可能是10或4,故C错误;
D、碳酸氢钠溶液中碳酸氢根离子水解大于电离,溶液中离子浓度大小为c(Na+)>c(HCO3-)>(OH-)>c(H2CO3)>c(H+),故D错误;
故选A.
点评 本题考查了电解质溶液中电荷守恒,物料守恒分析判断,溶液中离子浓度大小比较方法应用,弱电解质电离平衡分析是解题关键,题目难度中等.

练习册系列答案
相关题目
17.醋酸在日常生活和生产中的应用很广泛.
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈酸性(填“酸性”、“中性”或“碱性”),溶液中c(Na+)<c (CH3COO-)(填“>”、“=”或“<”).
(2)25℃时,向0.l mol•L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小.
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中:CH3COOH和CH3COO-两种粒子的物质的量之和等于0.lmol.
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是A.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定达终点时,发现滴定管尖嘴部分有气泡
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如表实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
①写出步骤2中溶液变红色的离子方程式Fe3++3SCN-?Fe(SCN)3;
②步骤3中现象a是出现白色沉淀;
③用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈酸性(填“酸性”、“中性”或“碱性”),溶液中c(Na+)<c (CH3COO-)(填“>”、“=”或“<”).
(2)25℃时,向0.l mol•L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小.
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中:CH3COOH和CH3COO-两种粒子的物质的量之和等于0.lmol.
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是A.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定达终点时,发现滴定管尖嘴部分有气泡
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如表实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
②步骤3中现象a是出现白色沉淀;
③用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
18.科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
N2(g)+O2(g)=2NO(g)△H3=+183 kJ•moL-1,上述△H1=-749kJ•moL-1.
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为CO-2e-+3OH-=HCO3-+H2O
(3)2CO(g)+2NO(g)?N2(g)+2CO2(g)的平衡常数表达式为K=$\frac{c(N2)•c2(CO2)}{c2(NO)•c2(CO)}$.图A中曲线Ⅱ(填“Ⅰ”或“Ⅱ”)能正确表示平衡常数与温度的关系,理由是该可逆反应的正反应为放热反应,升温平衡逆移,平衡常数减小.
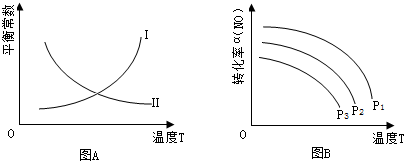
(4)当NO、CO浓度比为1时,体系中NO平衡转化率的平衡转化率(α)与温度、压强的关系如图B所 示.图B中,压强由小到大的顺序为P3<p2<p1,其判断理由是正反应是气体分子数减小的反应,其他条件不变时增大压强,平衡正移,NO转化率增大.
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
| 化学键 | N≡N键 | O=O键 | = ← N O键 |
| 键能/kJ•moL-1 | 945 | 498 | 630 |
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为CO-2e-+3OH-=HCO3-+H2O
(3)2CO(g)+2NO(g)?N2(g)+2CO2(g)的平衡常数表达式为K=$\frac{c(N2)•c2(CO2)}{c2(NO)•c2(CO)}$.图A中曲线Ⅱ(填“Ⅰ”或“Ⅱ”)能正确表示平衡常数与温度的关系,理由是该可逆反应的正反应为放热反应,升温平衡逆移,平衡常数减小.

(4)当NO、CO浓度比为1时,体系中NO平衡转化率的平衡转化率(α)与温度、压强的关系如图B所 示.图B中,压强由小到大的顺序为P3<p2<p1,其判断理由是正反应是气体分子数减小的反应,其他条件不变时增大压强,平衡正移,NO转化率增大.
15. 在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5molCO2、1.5molH2,平衡时CO2的转化率小于75% | |
| D. | 12min时,向上述容器中再充入0.25molCO2、0.25molH2O(g),此时反应将向逆反应方向进行 |
2.下列说法正确的是( )
| A. | 丁达尔现象可以用来区别胶体和溶液 | |
| B. | 水银、水玻璃、胆矾都是纯净物 | |
| C. | HCl、NH3、BaSO4都是电解质 | |
| D. | H2、D2、T2属于同素异形体 |
12.化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是( )
| A. | 硫酸生产中常采用高压条件提高SO2的转化率 | |
| B. | 合成氨中采用及时分离氨气提高反应速率 | |
| C. | 电解精炼铜时,溶液中c(Cu2+)会略有减小 | |
| D. | 氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气 |
19.下列有关化学反应能量的叙述正确的是( )
| A. | 放热反应都不需要加热 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
17.几种短周期元素的原子半径及主要化合价如下表:
下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径/(10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | 由元素X和Q组成的化合物不可能含有共价键 | |
| B. | X、Z、R的最高价氧化物对应水化物可彼此反应 | |
| C. | Y-半径比Q2-半径大 | |
| D. | M(OH)2的碱性比XOH的碱性弱 |