题目内容
8.下列事实能说明金属性钠比铝强的是( )| A. | 钠能与冷水剧烈反应,而铝不能与冷水反应 | |
| B. | NaOH易溶于水,Al(OH)3难溶于水 | |
| C. | 等物质的量的NaOH和Al(OH)3,Al(OH)3可以电离出更多OH- | |
| D. | 等物质的量铝比钠失去电子数多 |
分析 利用金属单质之间的置换反应、失去电子的难易程度、金属对应阳离子的氧化性、与水或酸反应的难易程度、金属的最高价氧化物对应水化物的碱性等来比较金属性的强弱.
解答 解:A、Na能与冷水反应,而Al不能,说明金属钠的活泼性强于金属镁,故A正确;
B、元素最高价氧化物对应水化物的碱的溶解性,不能证明金属的活泼性强弱,故B错误;
C、等物质的量的NaOH和Al(OH)3可以电离出氢氧根离子的数目不能证明金属的活泼性强弱,可以根据电离出氢氧根离子的难易判断,故C错误;
D、原子失电子的多少不能证明金属的活泼性强弱,可以根据原子失电子的难易来判断,故D错误.
故选A.
点评 本题考查元素金属性的强弱比较方法,明确常见的金属性比较的方法即可解答,难度中等.

练习册系列答案
相关题目
18.科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
N2(g)+O2(g)=2NO(g)△H3=+183 kJ•moL-1,上述△H1=-749kJ•moL-1.
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为CO-2e-+3OH-=HCO3-+H2O
(3)2CO(g)+2NO(g)?N2(g)+2CO2(g)的平衡常数表达式为K=$\frac{c(N2)•c2(CO2)}{c2(NO)•c2(CO)}$.图A中曲线Ⅱ(填“Ⅰ”或“Ⅱ”)能正确表示平衡常数与温度的关系,理由是该可逆反应的正反应为放热反应,升温平衡逆移,平衡常数减小.
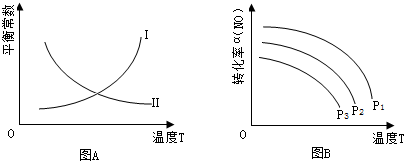
(4)当NO、CO浓度比为1时,体系中NO平衡转化率的平衡转化率(α)与温度、压强的关系如图B所 示.图B中,压强由小到大的顺序为P3<p2<p1,其判断理由是正反应是气体分子数减小的反应,其他条件不变时增大压强,平衡正移,NO转化率增大.
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
| 化学键 | N≡N键 | O=O键 | = ← N O键 |
| 键能/kJ•moL-1 | 945 | 498 | 630 |
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为CO-2e-+3OH-=HCO3-+H2O
(3)2CO(g)+2NO(g)?N2(g)+2CO2(g)的平衡常数表达式为K=$\frac{c(N2)•c2(CO2)}{c2(NO)•c2(CO)}$.图A中曲线Ⅱ(填“Ⅰ”或“Ⅱ”)能正确表示平衡常数与温度的关系,理由是该可逆反应的正反应为放热反应,升温平衡逆移,平衡常数减小.

(4)当NO、CO浓度比为1时,体系中NO平衡转化率的平衡转化率(α)与温度、压强的关系如图B所 示.图B中,压强由小到大的顺序为P3<p2<p1,其判断理由是正反应是气体分子数减小的反应,其他条件不变时增大压强,平衡正移,NO转化率增大.
19.下列有关化学反应能量的叙述正确的是( )
| A. | 放热反应都不需要加热 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
13.常温下,下列溶液肯定呈碱性的是( )
| A. | 溶液中含有OH- | B. | 与氯化铵溶液反应放出氨气 | ||
| C. | 与金属铝反应放出氢气 | D. | 滴入甲基橙试液后,溶液呈黄色 |
20.现有标准状况下氢气和甲烷组成的混合气体112L,使其完全燃烧生成H2O(l)和CO2,实验测得反应放热3695kJ.已知:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
CH4 (g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1
则原混合气体中H2与CH4的质量之比约为( )
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
CH4 (g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1
则原混合气体中H2与CH4的质量之比约为( )
| A. | 1:3 | B. | 3:1 | C. | 1:24 | D. | 24:1 |
17.几种短周期元素的原子半径及主要化合价如下表:
下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径/(10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | 由元素X和Q组成的化合物不可能含有共价键 | |
| B. | X、Z、R的最高价氧化物对应水化物可彼此反应 | |
| C. | Y-半径比Q2-半径大 | |
| D. | M(OH)2的碱性比XOH的碱性弱 |
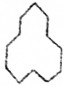 名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.
名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.