题目内容
15.甲、乙两种非金属性质比较:①甲的单质熔、沸点比乙的低;②甲单质能氧化乙元素的阴离子;③最高价氧化物对应的水化物酸性比较,甲比乙的强;④与金属反应时甲原子得电子的数目比乙多;⑤甲单质比乙单质容易与氢气化合.其中能够说明甲比乙的非金属性强的是( )| A. | ①②⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
分析 根据气态氢化物的稳定性、最高价氧化物对应的水化物酸性、与氢气化合的难易程度、阴离子的还原性等来判断非金属性的强弱.
解答 解:①熔沸点属于物理性质,与元素的非金属性无关,甲的单质熔沸点比乙的低,无法确定非金属的关系,故①错误;
②甲单质能与乙阴离子发生氧化还原反应,则甲的非金属性比乙强,故②正确;
③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强,则甲的非金属性比乙强,故③正确;
④与金属反应时,甲原子得电子数目比乙的多,但得电子不一定容易,则不能说明甲比乙的非金属性强,故④错误;
⑤甲比乙更容易与氢气化合,则甲的非金属性比乙强,故⑤正确;
显然②③⑤能说明甲比乙的非金属性强,
故选C.
点评 本题考查非金属性的比较,熟悉元素周期律及非金属性比较的方法是解答本题的关键,学生应注意在学习中对规律性知识进行总结,题目难度不大.

练习册系列答案
相关题目
5.某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2.按如下流程可制得Cu3N和铁红.下列说法不正确的是( )
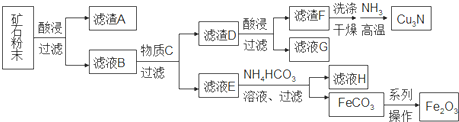

| A. | 在生成Cu3N的反应中,氨气做氧化剂 | |
| B. | 加入NH4HCO3溶液在生成白色沉淀的同时会放出有刺激气味的气体 | |
| C. | 虑液G可以并入滤液E加以利用 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
3.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| B. | 在标准状况下,2.24L乙烷中含有的化学键数为0.6NA | |
| C. | 100mL 0.1mol•L-1 Na2SO4溶液中含有的O原子数为0.04NA | |
| D. | 25℃时,1.0L pH=3的CH3COOH溶液中含有的H+数小于10-3 NA |
20.某学生用优质大理石与稀盐酸反应制取CO2,实验结果如图所示,对于该图的叙述正确的是( )

| A. | 整个OC段反应过程中,反应速率逐渐增大 | |
| B. | BC段收集到的气体最多 | |
| C. | 因为OA段盐酸浓度最大,所以该段反应速率最快 | |
| D. | AB段反应快主要是因为反应放热导致的 |
7.下列生活中常见用品和其主要成分对应正确的是( )
| A | B | C | D | |
| 用品名称 | 煤炭  | 酚醛树脂手柄 | 明矾  | 手工肥皂  |
| 主要成分 | C 碳单质 | 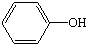 苯酚 | Al2(SO4)3•12H2O 十二水合硫酸铝 | C17H35COONa 硬脂酸钠 |
| A. | A | B. | B | C. | C | D. | D |
4.下列用于解释事实的方程式中,不合理的是( )
| A. | 氯水应保存在棕色试剂瓶内:2HClO$\frac{\underline{\;光照\;}}{\;}$H2O+Cl2↑ | |
| B. | 氯水具有杀菌、漂白作用:Cl2+H2O?HCl+HClO | |
| C. | 将氯水滴到淀粉KI试纸上,试纸变蓝:Cl2+2I-=2Cl-+I2 | |
| D. | 在实验室用漂白液和适量稀盐酸制取少量氯水:ClO-+Cl-+2H+=Cl2+H2O |
5.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}/高温}{→}$SiCl4$\stackrel{H_{2}/高温}{→}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg |
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0
甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0