题目内容
10.如图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是图①-④中的②③(填序号).
分析 根据氯化钠晶体中钠离子或氯离子的配位数判断其结构图是否正确,钠离子或氯离子的配位数都是6.
解答 解:由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-同样每个Cl-周围同时吸引着最近的等距离的6个Na+,图②中符合条件,图③中选取其中一个离子,然后沿X、Y、Z三轴切割得到6个等距离的且最近的带相反电荷的离子,所以其配位数也是6,故符合条件,
故答案为:②③.
点评 本题考查离子晶体的结构,明确氯化钠中离子的配位数是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
20.X、Y、Z三种元素原子的核电荷数在10~18之间,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4.则下列判断正确的是( )
| A. | 非金属性:X<Y<Z | |
| B. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| C. | 原子半径:按X、Y、Z变小 | |
| D. | 气态氢化物稳定性:按X、Y、Z顺序减弱 |
1.X、Y均为第3周期主族非金属元素,且Y的族序数大于X的族序数.下列说法正确的是( )
| A. | 原子序数:X>Y | |
| B. | 非金属性:X>Y | |
| C. | 最高价氧化物对应的水化物酸性:X>Y | |
| D. | 原子半径:X>Y |
5.下列实验操作与预期的实验结论或实验目的一致的是( )
| 选项 | 实验操作及现象 | 实验结论或实验目的 |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 溶液中有Na+,无K+ |
| B | 向硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 非金属性:Cl>Si |
| C | 向Ba(NO3)2溶液中通入SO2,有白色沉淀产生 | SO2具有还原性 |
| D | 将含少量KNO3杂质的NaCl晶体制成热的饱和溶液,冷却结晶,过滤 | 除去NaCl中的KNO3杂质 |
| A. | A | B. | B | C. | C | D. | D |
15.甲、乙两种非金属性质比较:①甲的单质熔、沸点比乙的低;②甲单质能氧化乙元素的阴离子;③最高价氧化物对应的水化物酸性比较,甲比乙的强;④与金属反应时甲原子得电子的数目比乙多;⑤甲单质比乙单质容易与氢气化合.其中能够说明甲比乙的非金属性强的是( )
| A. | ①②⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
19.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 离子半径:r(Z2+)>r(Y2-) | |
| B. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物强 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | X、Y、Z、W元素的最高正价均等于其所在族的族序数 |
20.下列物质的性质与应用对应关系错误的是( )
| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
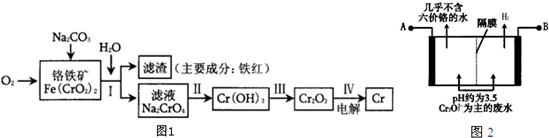
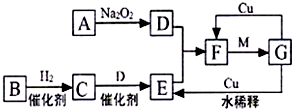 下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体.
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体.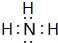 .
.