题目内容
如表是短周期中部分元素的原子半径及主要化合价.
请回答:
(1)Y在元素周期表中的位置是 ,镁条在盛有YW2气体的集气瓶中燃烧的现象为 ,化学方程式为
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是
(3)W、X、Y分别与U可形成10电子共价化合物,分别写出它们的化学式
(4)现有Z与V2W2的固体混合物样品,加入稀盐酸至混合物完全溶解,所得的混合液中c(Z3+):c(H+):c(Cl-)=1:2:8,则原固体混合物中,Z元素与W元素的质量比为 (最简整数比).
| 元素代号 | U | V | W | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 | 0.143 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 |
(1)Y在元素周期表中的位置是
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是
(3)W、X、Y分别与U可形成10电子共价化合物,分别写出它们的化学式
(4)现有Z与V2W2的固体混合物样品,加入稀盐酸至混合物完全溶解,所得的混合液中c(Z3+):c(H+):c(Cl-)=1:2:8,则原固体混合物中,Z元素与W元素的质量比为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:主族元素中,元素最高化合价与其族序数相等,最大化合价=族序数-8,同一主族元素中,原子半径随着原子序数增大而增大,同一周期元素中,原子半径随着原子序数增大而减小,根据表中化合价知,U、V为第IA族元素,W属于第VIA族元素,X属于第VA族元素,Y属于第IV族元素,Z属于第IIIA族元素,U原子半径最小则U为H元素,X原子半径和Y相近且X原子半径小于Y且都小于V,则Y为C、X为N元素、V为Na元素;Z原子半径和V相近,则Z为Al元素;W原子半径小于X,则W为O元素,据此答题.
解答:
解:主族元素中,元素最高化合价与其族序数相等,最大化合价=族序数-8,同一主族元素中,原子半径随着原子序数增大而增大,同一周期元素中,原子半径随着原子序数增大而减小,根据表中化合价知,U、V为第IA族元素,W属于第VIA族元素,X属于第VA族元素,Y属于第IV族元素,Z属于第IIIA族元素,U原子半径最小则U为H元素,X原子半径和Y相近且X原子半径小于Y且都小于V,则Y为C、X为N元素、V为Na元素;Z原子半径和V相近,则Z为Al元素;W原子半径小于X,则W为O元素,
(1)Y为碳元素,在元素周期表中第二周期第ⅣA族,镁条在盛有CO2气体的集气瓶中燃烧会产生氧化镁和碳,所以可以看到有黑烟产生,化学方程式为CO2+2Mg
2MgO+C,
故答案为:第二周期第ⅣA族;有黑烟产生;CO2+2Mg
2MgO+C;
(2)V是Na元素、W是O元素、Z为Al元素,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以Na、O、Al三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(3)W、X、Y分别与U可形成10电子共价化合物,它们分别为H2O、NH3、CH4,故答案为:H2O、NH3、CH4;
(4)反应有HCl剩余,溶液为NaCl、HCl、AlCl3混合溶液,同一溶液中离子浓度之比等于物质的量之比,令n(Al3+)、n(H+)、n(Cl-)分别为1mol、2mol、8mol,根据电荷守恒,可知n(Na+)=n(Cl-)-n(H+)-3n(Al3+)=8mol-2mol-1mol×3=3mol,结合守恒可知,原混合物中n(Al)=n(Al3+)=1mol,n(O原子)=n(Na+)=3mol,故m(Al):(O元素)=1mol×27g/mol:3mol×16g/mol=9:16,
故答案为:9:16.
(1)Y为碳元素,在元素周期表中第二周期第ⅣA族,镁条在盛有CO2气体的集气瓶中燃烧会产生氧化镁和碳,所以可以看到有黑烟产生,化学方程式为CO2+2Mg
| ||
故答案为:第二周期第ⅣA族;有黑烟产生;CO2+2Mg
| ||
(2)V是Na元素、W是O元素、Z为Al元素,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以Na、O、Al三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(3)W、X、Y分别与U可形成10电子共价化合物,它们分别为H2O、NH3、CH4,故答案为:H2O、NH3、CH4;
(4)反应有HCl剩余,溶液为NaCl、HCl、AlCl3混合溶液,同一溶液中离子浓度之比等于物质的量之比,令n(Al3+)、n(H+)、n(Cl-)分别为1mol、2mol、8mol,根据电荷守恒,可知n(Na+)=n(Cl-)-n(H+)-3n(Al3+)=8mol-2mol-1mol×3=3mol,结合守恒可知,原混合物中n(Al)=n(Al3+)=1mol,n(O原子)=n(Na+)=3mol,故m(Al):(O元素)=1mol×27g/mol:3mol×16g/mol=9:16,
故答案为:9:16.
点评:本题主要考查了常见元素化合物知识、离子半径比较、10电子结构、化学计算等知识,中等难度,解题的关键是元素推断,答题的难点是计算,答题时要注意运用守恒思想进行化学计算.

练习册系列答案
相关题目
同温同压下两个容积相等的贮气瓶,一个装有NO气体,另一个装有O2和N2的混合气体,则两瓶内的气体不一定相同的是( )
| A、气体质量 | B、气体的物质的量 |
| C、分子总数 | D、原子数 |
火星表面还有火星表面还有黄钾铁矾,其组成的化学式为KFe3(SO4)2(OH)6,易溶于稀硫酸,下列说法不正确的是( )
| A、黄钾铁矾中铁元素显+3价 |
| B、黄钾铁矾属于碱 |
| C、黄钾铁矾溶于硫酸后,滴加KSCN溶液,溶液变红 |
| D、黄钾铁矾晶体在酒精灯火焰上灼烧,透过蓝色的钴玻璃可观察到紫色火焰 |
0.1mol/L氨水中,溶液中随着水量的增加而减少的是( )
A、
| ||
B、
| ||
| C、C(H+)和C(OH-)的乘积 | ||
| D、OH-的物质的量 |
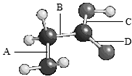 如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.
如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.