题目内容
普通锌锰干电池的外壳是锌筒,内置一个碳棒作电极,工作时发生的反应为:
2Zn+4NH4Cl+4MnO2═Zn(NH3)4Cl2+ZnCl2+2Mn2O3+2H2O
下列有关说法不正确的是( )
2Zn+4NH4Cl+4MnO2═Zn(NH3)4Cl2+ZnCl2+2Mn2O3+2H2O
下列有关说法不正确的是( )
| A、干电池的负极是锌筒 |
| B、MnO2在碳棒上发生还原反应 |
| C、闲置时间过长干电池也会失去供电能力 |
| D、工作时电解液中的NH4+移向负极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.该原电池中,失电子的金属作负极;
B.得电子的物质发生还原反应;
C.闲置过程中锌易被酸性物质腐蚀;
D.放电时,阳离子向正极移动.
B.得电子的物质发生还原反应;
C.闲置过程中锌易被酸性物质腐蚀;
D.放电时,阳离子向正极移动.
解答:
解:A.该原电池中,锌的化合价由0价变为+2价,所以锌作负极,故A正确;
B.锰元素化合价由+4价变为+3价,MnO2在碳棒上得电子发生还原反应,故B正确;
C.氯化铵是强酸弱碱盐,其溶液呈酸性,锌和酸反应生成锌离子而被腐蚀,故C正确;
D.放电时,铵根离子向正极移动,故D错误;
故选D.
B.锰元素化合价由+4价变为+3价,MnO2在碳棒上得电子发生还原反应,故B正确;
C.氯化铵是强酸弱碱盐,其溶液呈酸性,锌和酸反应生成锌离子而被腐蚀,故C正确;
D.放电时,铵根离子向正极移动,故D错误;
故选D.
点评:本题考查了原电池原理,根据得失电子判断正负极及其反应,再结合离子移动方向、盐类水解来分析解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、22.4LSO2与0.5molO2混合催化氧化,生成NA个SO3分子 |
| B、1mol乙炔在空气中燃烧,一定生成2NA个CO2分子 |
| C、1molCl2与1molCH4恰好完全反应,则转移的电子总数为2NA |
D、 11g某硫化磷(如图)中含P-S键数目为0.45NA |
常温下,0.1mol?L-1某一元酸(HA)溶液的pH=3,下列叙述正确的是( )
| A、该溶液中由水电离出的c(H+)=1×10-3mol?L-1 |
| B、pH=2的HA溶液与pH=3的HCl溶液:c(HA)=10 c(HCl) |
| C、pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| D、0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合后所得的溶液中:c(A-)+c(HA)=0.05mol?L-1 |
在某无色呈强酸性的溶液中,能大量共存的离子组是( )
| A、Na+、S2-、K+、NO3- |
| B、NH4+、NO3-、Al3+、K+ |
| C、MnO4-、K+、CO32-、Na+ |
| D、K+、SO42-、HCO3-、Na+ |
下列离子方程式书写正确的是( )
A、用铂作电极电解MgCl2溶液:2Cl-+2H2O
| ||||
B、用石墨电极电解氯化铜溶液:Cu2++2Cl-+2H2O
| ||||
C、向Ca(HCO3)2溶液中滴加少量的NaOH溶液:Ca2++HC
| ||||
| D、将少量氯气通入溴化亚铁溶液中:2Br-+Cl2═Br2+2Cl- |
 已知:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,Y原子最外层电子数是内层电子数的两倍,Z的原子序数是Y的两倍,在元素周期表中W元素位于第11列.
已知:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,Y原子最外层电子数是内层电子数的两倍,Z的原子序数是Y的两倍,在元素周期表中W元素位于第11列. 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答: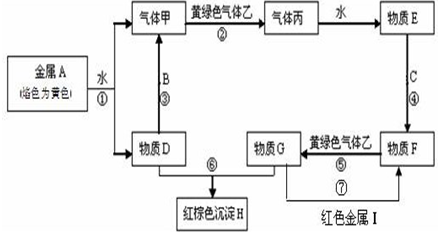 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).