题目内容
25g CuSO4?5H2O固体溶于水配成500mL溶液,其浓度为 mol?L-1,从中取出100mL溶液,其SO42-的浓度为 mol?L-1;再把取出的溶液加水稀释成500mL,则此时溶液的浓度为 mol?L-1.
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:c=
计算溶质物质的量浓度,溶液是均一稳定的分散系,溶质浓度不随溶液体积改变,稀释溶液溶质物质的量不变分析判断.
| n |
| V |
解答:
解:25g CuSO4?5H2O固体物质的量=
=0.1mol,溶于水配成500mL溶液,溶质浓度c=
=0.2 mol?L-1;
从中取出100mL溶液,溶液是均一稳定的分散系,浓度不变,所以其SO42-的浓度为0.2 mol?L-1;
再把取出的溶液加水稀释成500mL,稀释前后溶质物质的量不变,所以得到溶液浓度=
=0.04 mol?L-1;
故答案为:0.2;0.2;0.04.
| 25g |
| 250g/mol |
| 0.1mol |
| 0.5L |
从中取出100mL溶液,溶液是均一稳定的分散系,浓度不变,所以其SO42-的浓度为0.2 mol?L-1;
再把取出的溶液加水稀释成500mL,稀释前后溶质物质的量不变,所以得到溶液浓度=
| 0.1L×0.2mol/L |
| 0.5L |
故答案为:0.2;0.2;0.04.
点评:本题考查了溶液浓度的计算分析,溶液性质的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
A、用铂作电极电解MgCl2溶液:2Cl-+2H2O
| ||||
B、用石墨电极电解氯化铜溶液:Cu2++2Cl-+2H2O
| ||||
C、向Ca(HCO3)2溶液中滴加少量的NaOH溶液:Ca2++HC
| ||||
| D、将少量氯气通入溴化亚铁溶液中:2Br-+Cl2═Br2+2Cl- |
在Na2CO3溶液中,下列关系式错误的是( )
| A、c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B、c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| C、c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、c(CO32-)>c(OH-)>c(HCO3-) |
 在25℃时,向弱酸HAc中逐滴滴人NaOH溶液,在不同的pH下,HAc分子与Ac-离子的含量如图所示,则下列说法正确的是( )
在25℃时,向弱酸HAc中逐滴滴人NaOH溶液,在不同的pH下,HAc分子与Ac-离子的含量如图所示,则下列说法正确的是( )| A、当pH<2.6时,HAc不电离 |
| B、O点时.HAc恰好与NaOH完全反应 |
| C、pH=6.4时溶液中溶质只有NaAc |
| D、50℃,曲线交点O点pH<4.76 |
下列离子方程式正确的是( )
| A、钠投入水中:Na+H2O=Na++OH-+H2↑ |
| B、HCl溶液与NaOH溶液反应:H++OH-=H2O |
| C、石灰石溶于盐酸中:CO32-+H+=CO2↑+H2O |
| D、Zn与H2SO4溶液反应:Zn+2H+=Zn2++H2↑ |
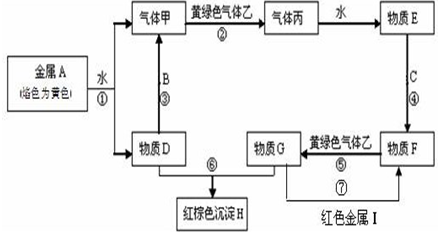 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).