题目内容
17.下表列出A~K九种元素在周期表中的位置:| 周 期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VII A | 0 |
| 2 | E | G | H | |||||
| 3 | A | C | D | I | K | |||
| 4 | B | J |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(3)ABC这三种元素的原子半径由大到小的顺序排列为K>Na>Mg.(写出元素符号)
(4)G元素氢化物的化学式是H2O,该氢化物在常温下跟B反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的PH>7.(填>、=、<)
(5)在该周期表中,最高价氧化物对应的水化物中碱性最强的是KOH;最高价氧化物对应的水化物中酸性最强的是HClO4;气态氢化物最稳定的是HF.(写出物质的化学式)
分析 (1)由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、G为氧、H为氟、I为Cl、J为Br、R为Ar;
(2)D元素的最高价氧化物对应的水化物为氢氧化钠,与氢氧化钠反应生成偏铝酸钠与水;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)G元素氢化物为H2O,常温下跟B(钾)反应生成KOH与氢气;
(5)最高价氧化物对应的水化物中碱性最强的是KOH,最高价氧化物对应的水化物中酸性最强的是高氯酸,
F元素非金属性最强,气态氢化物最稳定的是HF.
解答 解:(1)由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、G为氧、H为氟、I为Cl、J为Br、R为Ar,
故答案为:Na;K;Al;O
(2)D元素的最高价氧化物对应的水化物为氢氧化钠,与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径K>Na>Mg,
故答案为:K>Na>Mg;
(4)G元素氢化物为H2O,常温下跟B(钾)反应生成KOH与氢气,反应方程式为:2K+2H2O=2KOH+H2↑,溶液呈碱性,即pH>7,
故答案为:H2O;2K+2H2O=2KOH+H2↑;>;
(5)最高价氧化物对应的水化物中碱性最强的是KOH,最高价氧化物对应的水化物中酸性最强的是HClO4,
F元素非金属性最强,气态氢化物最稳定的是HF,
故答案为:KOH;HClO4;HF.
点评 本题考查元素周期表与元素周期律的综合应用,比较基础,注意对元素周期表的整体把握,理解掌握元素周期律及应用.

练习册系列答案
相关题目
7.有关苯的说法正确的是( )
| A. | 极易溶于水 | B. | 分子为平面正六边形结构 | ||
| C. | 是衡量石油化工发展水平的标志 | D. | 能使紫色的酸性KMnO4溶液褪色 |
5.除去苯中少量苯酚的方法是( )
| A. | 加FeCl3溶液、分液 | B. | 加浓溴水、过滤 | ||
| C. | 加液溴反应后蒸馏 | D. | 加NaOH溶液、分液 |
12.下列属于同位素的一组是( )
| A. | ${\;}_{1}^{2}$H、${\;}_{1}^{1}$H | B. | 红磷、白磷 | ||
| C. | Na2O、Na2O2 | D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca |
9.短周期元素a、b、c、d的原子序数依次增大.c、a、b最外层电子数为等差数列.公差为2.a、c的价电子数之和为6.d的核外电子数等于b的核外电子数加8.下列叙述错误的是( )
| A. | a和b可形成气态化合物 | |
| B. | c的原子半径小于d的原子半径 | |
| C. | b和c形成的化合物为离子化合物 | |
| D. | a和d最高价氧化物的水化物均呈酸性 |
6.常温下,下列溶液中c(H+)最小的是( )
| A. | 0.01mol•L-1的H2SO4溶液 | B. | 0.01mol•L-1的Ba(OH)2溶液 | ||
| C. | c(OH-)=1×10-11mol•L-1的溶液 | D. | c(H+)=1×10-12mol•L-1的溶液 |
7. 用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )
用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )
 用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )
用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | C点:c(Na+)=c(HA-)+2c(OH-) | |
| D. | 水电离出来得c(OH-):B>D |
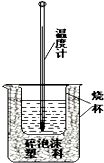 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: