题目内容
9.短周期元素a、b、c、d的原子序数依次增大.c、a、b最外层电子数为等差数列.公差为2.a、c的价电子数之和为6.d的核外电子数等于b的核外电子数加8.下列叙述错误的是( )| A. | a和b可形成气态化合物 | |
| B. | c的原子半径小于d的原子半径 | |
| C. | b和c形成的化合物为离子化合物 | |
| D. | a和d最高价氧化物的水化物均呈酸性 |
分析 c、a、b最外层电子数为等差数列,公差为2,可为1、3、7或2、4、6,a、c的价电子数之和为6,则c的最外层电子数为2,a的最外层电子数为4,b的最外层电子数为6,d的核外电子数等于b的核外电子数加8,则b、d位于同一主族,b为O元素,d为S元素,由原子序数关系可知a为C元素,C为Mg,以此解答该题.
解答 解:c、a、b最外层电子数为等差数列,公差为2,可为1、3、7或2、4、6,a、c的价电子数之和为6,则c的最外层电子数为2,a的最外层电子数为4,b的最外层电子数为6,d的核外电子数等于b的核外电子数加8,则b、d位于同一主族,b为O元素,d为S元素,由原子序数关系可知a为C元素,C为Mg,
A.a和b可形成的化合物有CO、CO2等,故A正确;
B.Mg、S位于同一周期,同周期元素原子半径从左到右逐渐减小,则Mg>S,故B错误;
C.b和c形成的化合物为MgO,为离子化合物,故C正确;
D.a为C,d为S,都为非金属性,对应的最高价氧化物的水化物分别为碳酸、硫酸,故D正确.
故选B.
点评 本题考查性质结构与位置关系应用,推断元素是关键,充分利用核外电子排布规律及结构与位置关系进行推断,是对学生综合能力的考查.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
19.下列物质中,可作为绿色燃料的是( )
| A. | 汽油 | B. | 煤 | C. | 石油 | D. | 氢气 |
20.在0.1mol•L-1醋酸溶液中加入少量0.1mol•L-1盐酸,下列叙述正确的是( )
| A. | CH3COOH的电离程度增大,c(H+)增大 | |
| B. | 平衡向生成CH3COOH移动,c(H+)减小 | |
| C. | CH3COOH电离程度减小,pH减小 | |
| D. | 电离平衡向生成CH3COO-、H+方向移动,pH减小 |
17.下表列出A~K九种元素在周期表中的位置:
(1)请写出下列元素的元素符号ANaBKDAlGO..
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(3)ABC这三种元素的原子半径由大到小的顺序排列为K>Na>Mg.(写出元素符号)
(4)G元素氢化物的化学式是H2O,该氢化物在常温下跟B反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的PH>7.(填>、=、<)
(5)在该周期表中,最高价氧化物对应的水化物中碱性最强的是KOH;最高价氧化物对应的水化物中酸性最强的是HClO4;气态氢化物最稳定的是HF.(写出物质的化学式)
| 周 期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VII A | 0 |
| 2 | E | G | H | |||||
| 3 | A | C | D | I | K | |||
| 4 | B | J |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(3)ABC这三种元素的原子半径由大到小的顺序排列为K>Na>Mg.(写出元素符号)
(4)G元素氢化物的化学式是H2O,该氢化物在常温下跟B反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的PH>7.(填>、=、<)
(5)在该周期表中,最高价氧化物对应的水化物中碱性最强的是KOH;最高价氧化物对应的水化物中酸性最强的是HClO4;气态氢化物最稳定的是HF.(写出物质的化学式)
4.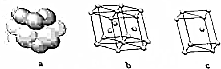 A到F是原子序数依次增大的前四周期元素:
A到F是原子序数依次增大的前四周期元素:
回答下列问题:
(1)写出E、F的元素符号Mg、Cr,B、C、D元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示),A元素分别与B、D元素形成的两种微粒都具有与NH3相似的结构,属于等电子体,它们的化学式依次是CH3-、H3O+.
(2)在CH3Cl、C6H6、HCHO、CH3OH、CH≡CH中,碳原子采取sp2杂化的有C6H6、HCHO;应用价层电子对互斥理论,预测COCl2的空间构型为平面三角形.
(3)F元素的原子基态价层电子排布图是 .
.
(4)E单质晶体中原子的堆积模型如图,晶胞是图中的c(填“a”、“b”或“c”);配位数是12‘若紧邻的四个E原子的中心连线构成的几何体的体积是Vcm3,E单质的密度为ρg•cm-3,则E的相对原子质量是计算式是6NA•V•ρ.
 A到F是原子序数依次增大的前四周期元素:
A到F是原子序数依次增大的前四周期元素:| A | A是原子半径最小的元素 |
| B | B基态原子的价层电子排布式为nsnnpn |
| D | D原子最外层电子数是次外层电子数的三倍 |
| E | C的三价阴离子和E的二价阳离子具有相同的电子层结构 |
| F | F元素的基态原子有六个成单电子 |
(1)写出E、F的元素符号Mg、Cr,B、C、D元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示),A元素分别与B、D元素形成的两种微粒都具有与NH3相似的结构,属于等电子体,它们的化学式依次是CH3-、H3O+.
(2)在CH3Cl、C6H6、HCHO、CH3OH、CH≡CH中,碳原子采取sp2杂化的有C6H6、HCHO;应用价层电子对互斥理论,预测COCl2的空间构型为平面三角形.
(3)F元素的原子基态价层电子排布图是
 .
.(4)E单质晶体中原子的堆积模型如图,晶胞是图中的c(填“a”、“b”或“c”);配位数是12‘若紧邻的四个E原子的中心连线构成的几何体的体积是Vcm3,E单质的密度为ρg•cm-3,则E的相对原子质量是计算式是6NA•V•ρ.
14.下列关于NH4N03、KN03的说法正确的是( )
| A. | NH4N03是离子化合物,KN03是共价化合物 | |
| B. | NH4N03是共价化合物,KN03是离子化合物 | |
| C. | NH4N03和KN03都是离子化合物 | |
| D. | NH4N03和KN03都是共价化合物 |
1.下列说法正确的是( )
| A. | 漂白粉漂白物质时发生的发应和变质失效时的反应一样 | |
| B. | 将氯气溶于水中,当水中各成分浓度保持不变时,即表示反应停止 | |
| C. | 二氧化硅固体是由原子直接构成的,那么固态二氧化碳也是由原子直接构成 | |
| D. | 碱金属(如钾、钠等)可以存放在所有有机溶剂中,而白磷则应保存在水中 |
18.鉴别乙醇和汽油,最简单的方法是( )
| A. | 加金属钠,有气体产生的是乙醇 | |
| B. | 加水,互溶的是乙醇 | |
| C. | 点燃,容易燃烧的是乙醇 | |
| D. | 和浓硫酸混合共热至170℃,有乙烯产生的是乙醇 |
19.关于碱金属元素的下列叙述中,错误的是( )
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大 | |
| C. | 随核电荷数递增,氢氧化物碱性增强 | |
| D. | 随电子层数增加,原子半径增大,金属还原性和金属性增强 |