题目内容
2.某一化学反应中,气体A的浓度在10s内由2.0mol/L变成0.5mol/L,在这10s内A的化学反应速率为?分析 反应速率表示单位时间内浓度的变化量,即反应速率v=$\frac{△C}{△t}$=$\frac{\frac{△n}{V}}{△t}$,据此计算.
解答 解:反应速率表示单位时间内浓度的变化量,则10s内A的化学反应速率=$\frac{2.0mol/L-0.5mol/L}{10s}$=0.15mol/(L•s);
故答案为:0.15mol/(L•s).
点评 本题考查反应速率的计算,根据反应速率公式进行计算,注意纯液体、固体浓度一般认为是常数,其浓度在反应中不变.

练习册系列答案
相关题目
12.对于反应A2+3B2═2C来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=1.2mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(B2)=0.8 mol/(L•s) |
13.在水中加入下列物质,能促进水的电离的是( )
| A. | H2SO4 | B. | KOH | C. | FeCl3 | D. | Ba (NO3)2 |
10.如图是有关电化学的图示,完全正确的是( )
| A. |  Cu-Zn原电池 | B. |  粗铜的精炼 | C. |  铁片镀锌 | D. |  减缓铁腐蚀 |
17.下表列出A~K九种元素在周期表中的位置:
(1)请写出下列元素的元素符号ANaBKDAlGO..
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(3)ABC这三种元素的原子半径由大到小的顺序排列为K>Na>Mg.(写出元素符号)
(4)G元素氢化物的化学式是H2O,该氢化物在常温下跟B反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的PH>7.(填>、=、<)
(5)在该周期表中,最高价氧化物对应的水化物中碱性最强的是KOH;最高价氧化物对应的水化物中酸性最强的是HClO4;气态氢化物最稳定的是HF.(写出物质的化学式)
| 周 期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VII A | 0 |
| 2 | E | G | H | |||||
| 3 | A | C | D | I | K | |||
| 4 | B | J |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(3)ABC这三种元素的原子半径由大到小的顺序排列为K>Na>Mg.(写出元素符号)
(4)G元素氢化物的化学式是H2O,该氢化物在常温下跟B反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的PH>7.(填>、=、<)
(5)在该周期表中,最高价氧化物对应的水化物中碱性最强的是KOH;最高价氧化物对应的水化物中酸性最强的是HClO4;气态氢化物最稳定的是HF.(写出物质的化学式)
7.下列关于极性键的叙述不正确的是( )
| A. | 由不同种元素原子形成的共价键 | |
| B. | 由同种元素的两个原子形成的共价键 | |
| C. | 分子中必定含有极性键 | |
| D. | 共同电子对必然偏向吸引电子能力强的原子一方 |
14.下列关于NH4N03、KN03的说法正确的是( )
| A. | NH4N03是离子化合物,KN03是共价化合物 | |
| B. | NH4N03是共价化合物,KN03是离子化合物 | |
| C. | NH4N03和KN03都是离子化合物 | |
| D. | NH4N03和KN03都是共价化合物 |
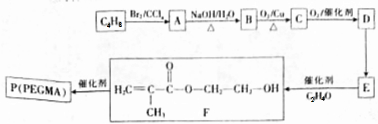
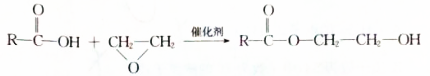
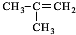 .
.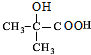 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$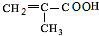 +H2O,该反应的反应类型是消去反应.
+H2O,该反应的反应类型是消去反应.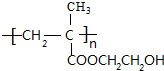 .
.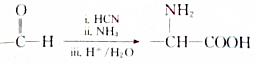 .设计由B合成
.设计由B合成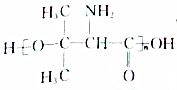 的路线.合成路线流程图请参考如下形式.
的路线.合成路线流程图请参考如下形式.
 .
.