题目内容
离子方程式H++OH-=H2O能表示的化学反应是( )
| A、Ca(OH)2+2CH3COOH=(CH3COO)2Ca+2H2O |
| B、HCl+NH3?H2O=NH4Cl+H2O |
| C、2HNO3+Ba(OH)2=Ba(NO3)2+2H2O |
| D、Mg(OH)2+H2SO4=MgSO4↓+2H2O |
考点:化学方程式的书写
专题:
分析:稀的强酸与稀的强碱生成可溶于盐和水的反应,可以用离子方程式H++OH-=H2O表示,以此来解答.
解答:
解:A.乙酸为弱酸,应该写化学式,离子方程式为:OH-+CH3COOH=CH3COO-+H2O,故A错误;
B.一水合氨为弱碱,应该写化学式,离子方程式为:H++NH3?H2O=NH4++H2O,故B错误;
C.硝酸,氢氧化钡都为易溶于水的强电解质,硝酸钡为易溶于水的盐,离子方程式为:H++OH-=H2O,故C正确;
D.氢氧化镁为沉淀,硫酸镁为易溶于水的盐,离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,故D错误;
故选C.
B.一水合氨为弱碱,应该写化学式,离子方程式为:H++NH3?H2O=NH4++H2O,故B错误;
C.硝酸,氢氧化钡都为易溶于水的强电解质,硝酸钡为易溶于水的盐,离子方程式为:H++OH-=H2O,故C正确;
D.氢氧化镁为沉淀,硫酸镁为易溶于水的盐,离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确物质的溶解性、常见的弱电解质在离子反应中应保留化学式是解答本题的关键,难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
下列实验事实不能用勒沙特列原理解释的是( )
A、 | ||||||
B、 | ||||||
C、 | ||||||
D、
|
在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(NO3-)为( )
| A、0.15 mol/L |
| B、0.20 mol/L |
| C、0.25 mol/L |
| D、0.40 mol/L |
下列关于物质分类的说法正确的是( )
| A、漂白粉、胆矾都属于混合物 |
| B、氧化铝、氯化钠都属于离子化合物 |
| C、氯化铵、次氯酸都属于强电解质 |
| D、二氧化硫、二氧化氮都属于酸性氧化物 |
根据如图,下列判断中正确的是( )
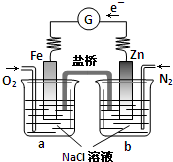

| A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、烧杯b中发生反应为Zn-2e-=Zn2+ |



 (5)下列关于化合物I、II、V、VI的说法正确的有
(5)下列关于化合物I、II、V、VI的说法正确的有