题目内容
下列实验事实不能用勒沙特列原理解释的是( )
A、 | ||||||
B、 | ||||||
C、 | ||||||
D、
|
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、二氧化氮生成四氧化二氮是放热反应,温度升高平衡向生成二氧化氮的方向移动;
B、该反应前后气体体积不变,加压平衡不移动,碘蒸气浓度增大;
C、沉淀转化可用于勒夏特列原理解释;
D、加水稀释促进次氯酸的电离.
B、该反应前后气体体积不变,加压平衡不移动,碘蒸气浓度增大;
C、沉淀转化可用于勒夏特列原理解释;
D、加水稀释促进次氯酸的电离.
解答:
解:A、二氧化氮生成四氧化二氮是放热反应,温度升高平衡向生成二氧化氮的方向移动,气体颜色加深,能够用勒夏特列原理解释,故A不选;
B、该反应前后气体体积不变,加压平衡不移动,碘蒸气浓度增大,颜色加深,不能够用勒夏特列原理解释,故B选;
C、沉淀能够转化为更难溶的程度,沉淀转化可用于勒夏特列原理解释,故C不选;
D、氯水中含有次氯酸,加水稀释次氯酸电离程度增大,能够用勒夏特列原理解释,故D不选;
故选B.
B、该反应前后气体体积不变,加压平衡不移动,碘蒸气浓度增大,颜色加深,不能够用勒夏特列原理解释,故B选;
C、沉淀能够转化为更难溶的程度,沉淀转化可用于勒夏特列原理解释,故C不选;
D、氯水中含有次氯酸,加水稀释次氯酸电离程度增大,能够用勒夏特列原理解释,故D不选;
故选B.
点评:本题考查了勒夏特列原理的应用,注意勒夏特列原理可以解释平衡体系中外界条件对化学平衡移动的影响,题目难度中等.

练习册系列答案
相关题目
下列的分离方法不正确的是( )
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用酒精萃取碘水中的碘 |
| D、用加热的方法除去苏打中的小苏打 |
下列化合物中,只能在溶液中才能导电的电解质是( )
| A、NaCl |
| B、H2SO4 |
| C、NH3 |
| D、CaO |
下列图示与对应的叙述不相符的是( )
A、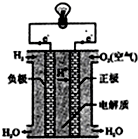 如图表示氢氧燃料电池构造示意图 |
B、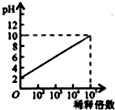 如图表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 |
C、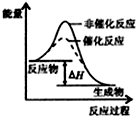 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
D、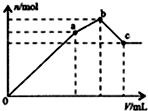 如图表示向NH4 Al(S04)2溶液中逐滴滴人Ba(OH)2溶液,生成沉淀总物质的量(n)随 着Ba(OH)2溶液体积(y)的变化 |
对于反应H2(g)+Cl2(g)═2HCl(g)(该反应为放热反应)的能量变化描述正确的是( )
| A、反应物总能量小于成物总能量 |
| B、断键和成键过程中都释放能量 |
| C、断键过程中吸收能量,成键过程中释放能量 |
| D、断键过程中释放能量,成键过程中吸收能量 |
已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39KJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46KJ?mol-1
H2(g)
O2(g)═H2O(l))△H=-285.84KJ?mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H20(l)的反应热△H等于( )
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46KJ?mol-1
H2(g)
| 1 |
| 2 |
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H20(l)的反应热△H等于( )
| A、-319.68kJ?mol-1 |
| B、-417.91kJ?mol-1 |
| C、+546.69kJ?mol-1 |
| D、-448.46kJ?mol-1 |
浓硫酸具有很强的吸水性,可作为气体干燥剂,但不能用浓硫酸干燥的气体是( )
| A、H2 |
| B、NH3 |
| C、N2 |
| D、HCl |
离子方程式H++OH-=H2O能表示的化学反应是( )
| A、Ca(OH)2+2CH3COOH=(CH3COO)2Ca+2H2O |
| B、HCl+NH3?H2O=NH4Cl+H2O |
| C、2HNO3+Ba(OH)2=Ba(NO3)2+2H2O |
| D、Mg(OH)2+H2SO4=MgSO4↓+2H2O |