题目内容
5.下列有关物质的性质或该物质性质的应用均正确的是( )| A. | 醋酸与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是相同的 | |
| C. | MgO和Al2O3常用于制作耐高温材料,工业上采用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
分析 A.含有弱酸根离子或弱碱阳离子的盐能发生水解;
B.明矾不能杀菌消毒;
C.依据工业制备镁的方法解答;
D.氯化亚铁溶液加热会水解生成氢氧化亚铁,氢氧化亚铁易被氧化为氢氧化铁.
解答 解:A.含有弱酸根离子或弱碱阳离子的盐能发生水解,醋酸是酸不能发生水解反应,故A错误;
B.明矾溶于水形成的氢氧化铝胶体能吸附不溶性固体杂质小颗粒,形成大颗粒,易于沉降,所以明矾净水,是利用胶体的吸附性,自来水是用强氧化性物质来消毒的,故B错误;
C.氧化镁熔点高,工业上电解熔融的氯化镁来制造金属镁,故C错误;
D.氯化亚铁溶液加热会水解生成氢氧化亚铁,氢氧化亚铁易被氧化为氢氧化铁,氢氧化铁受热分解生成氧化铁,所以氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁,故D正确;
故选:D.
点评 本题考查物质的性质及应用,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
16.下列各种冶炼方法中可以制得相应金属的是( )
| A. | 加热氧化铝 | B. | 加热碳酸钙 | ||
| C. | 电解熔融氯化钠 | D. | 氯化钠与铝粉高温共热 |
13.在①、②、③容积不等的恒容密闭容器中,均充入0.lmol CO和0.2mol H2,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:下列说法正确的是( )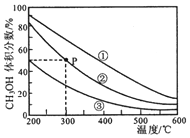

| A. | 该反应的正反应为放热反应 | |
| B. | 三个容器容积:①>②>③ | |
| C. | 在P点,CO转化率为75% | |
| D. | 在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆 |
20.下列溶液一定呈中性的是( )
| A. | PH=7的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 由强酸和强碱等物质的量反应得到的物质 | |
| D. | c (H+)=c (OH-) |
10.铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.请回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)?Fe(s)+CO2(g) K1△H1=a KJ•mol-1
3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g) K2△H2=b KJ•mol-1
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g) K3△H3=c KJ•mol-1
①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=$\frac{6a+b+2c}{3}$KJ•mol-1(用含a、b、c的代数式表示).
②上述反应对应的平衡常数K1、K2、K3随温度变化的曲线如图1所示.则a>b,(填“>”、“<”或“=”),理由是由图可知,随着温度的升高,K1增大、K2减小,则△H1>0、△H2<0,所以a>b.
(2)铁的氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,如图2,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是b.

(3)铁等金属可用作CO与H2反应的催化剂:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,将l mol CO和3mol H2加入2L的密闭容器中.实验测得n(CO)随时间的变化如表:
①下列能判断该反应达到平衡的标志是ad(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②在0~20min内v (H2)=0.04mol•L-1•min-1;在T℃时该反应的平衡常数K=1200.
③图3表示该反应中CO的转化率与温度、压强的关系.图中压强P1、P2、P3由高到低的顺序是P1>P2>P3.
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)?Fe(s)+CO2(g) K1△H1=a KJ•mol-1
3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g) K2△H2=b KJ•mol-1
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g) K3△H3=c KJ•mol-1
①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=$\frac{6a+b+2c}{3}$KJ•mol-1(用含a、b、c的代数式表示).
②上述反应对应的平衡常数K1、K2、K3随温度变化的曲线如图1所示.则a>b,(填“>”、“<”或“=”),理由是由图可知,随着温度的升高,K1增大、K2减小,则△H1>0、△H2<0,所以a>b.
(2)铁的氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应,如图2,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是b.

(3)铁等金属可用作CO与H2反应的催化剂:CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,将l mol CO和3mol H2加入2L的密闭容器中.实验测得n(CO)随时间的变化如表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n(CO)/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②在0~20min内v (H2)=0.04mol•L-1•min-1;在T℃时该反应的平衡常数K=1200.
③图3表示该反应中CO的转化率与温度、压强的关系.图中压强P1、P2、P3由高到低的顺序是P1>P2>P3.
14.镁锰干电池中反应的化学方程式为Mg+2MnO2+H2O═Mg (OH)2+Mn2O3.下列说法正确的是( )
| A. | 负极的电极反应式为Mg+2OH-+2e-═Mg(OH)2 | |
| B. | 电池放电时,OH-向负极移动 | |
| C. | 电解质溶液可以是稀H2SO4 | |
| D. | 正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- |
15.下列有关元素性质的叙述,不正确的是( )
| A. | HF、HCl、HBr、HI的稳定性逐渐减弱 | |
| B. | C、N、O、F的最高正化合价逐渐增大 | |
| C. | KOH、NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱 | |
| D. | SiH4、PH3、H2S、HCl的还原性逐渐减弱 |
