题目内容
草酸盐在无机功能材料的制备中具有分解温度低、纯度高、无污染的特点.例如在N2气氛下:FeC2O4
FeO+CO↑+CO2↑;2CoC2O4
Co+CoO+CO↑+3CO2↑.某化学兴趣小组决定设计实验探究CuC2O4加热后分解产物的成分
I.该小组首先对分解产物进行了猜测,下面是部分可能情况(未配平):
猜想1:CuC2O4
Cu2O+CO↑
猜想2:CuC2O4
CuO+CO2↑
猜想3:CuC2O4
CuO+CO↑+CO2↑
猜想4:CuC2O4
Cu+CuO+CO↑+CO2↑
…
通过分析,你认为 不合理,理由是 ;
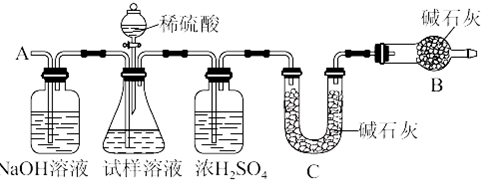
Ⅱ.检验气体产物的装置如下:
(1)装置通入N2的目的是
(2)装置E、F中装的试剂分别是 、
(3)检验结果气体产物只有CO2,则相关实验现象为
Ⅲ.经检验气体产物只有CO2,请推测固体产物成分并设计实验证明,将下列表格补充完整(可不填满).
已知:2Cu+O2
2CuO;4CuO
2Cu2O+O2↑;Cu2O+2HCl=CuCl2+Cu↓+H2O.
| ||
| ||
I.该小组首先对分解产物进行了猜测,下面是部分可能情况(未配平):
猜想1:CuC2O4
| △ |
猜想2:CuC2O4
| △ |
猜想3:CuC2O4
| △ |
猜想4:CuC2O4
| △ |
…
通过分析,你认为
Ⅱ.检验气体产物的装置如下:

(1)装置通入N2的目的是
(2)装置E、F中装的试剂分别是
(3)检验结果气体产物只有CO2,则相关实验现象为
Ⅲ.经检验气体产物只有CO2,请推测固体产物成分并设计实验证明,将下列表格补充完整(可不填满).
| 操作 | 预期实验现象和结论 |
| ||
| ||
考点:探究物质的组成或测量物质的含量
专题:
分析:I.根据反应中元素的化合价的变化分析;
II.(1)通入氮气可以把装置中的气体排入检验装置中,而且使装置中气压稳定,防止产生倒吸;
(2)检验CO用CuO粉末,检验CO前要先干燥;
(3)CO2能使澄清石灰水变浑浊,CO能还原CuO;
III.气体产物只有CO2,C元素的化合价升高,则Cu元素的化合价降低,则生成Cu,Cu不溶于盐酸.
II.(1)通入氮气可以把装置中的气体排入检验装置中,而且使装置中气压稳定,防止产生倒吸;
(2)检验CO用CuO粉末,检验CO前要先干燥;
(3)CO2能使澄清石灰水变浑浊,CO能还原CuO;
III.气体产物只有CO2,C元素的化合价升高,则Cu元素的化合价降低,则生成Cu,Cu不溶于盐酸.
解答:
解:I.CuC2O4中Cu元素的化合价为+2价,C为+3价,O为-2价;
猜想1:CuC2O4
Cu2O+CO↑反应中Cu、C元素的化合价均降低,不符合氧化还原反应原理;
猜想2:CuC2O4
CuO+CO2↑反应中C元素的化合价升高,不符合氧化还原反应原理;
故答案为:猜想1、猜想2;猜想1只有化合价的降低,猜想2只有化合价的升高,不符合氧化还原反应的原理;
II.(1)氮气性质稳定,对实验无干扰,通入氮气可以把装置中的气体排入检验装置中,而且使装置中气压稳定,防止产生倒吸;
故答案为:将分解生成的气体排到后面的装置中进行检验,并能防止倒吸;
(2)检验CO用CuO粉末,在加热条件下,CO还原CuO,则黑色固体变为红色,检验CO前要先干燥,所以E装置中为浓硫酸,用于干燥CO;
故答案为:浓硫酸;CuO;
(3)CO2能使澄清石灰水变浑浊,在加热条件下CO能还原CuO,则黑色固体变为红色,若只有CO2,则澄清石灰水变浑浊,其它装置中无明显现象;
故答案为:B中澄清石灰水变浑浊,其它装置中无明显现象;
III.气体产物只有CO2,C元素的化合价升高,则反应中Cu元素的化合价降低,则生成的固体中只有Cu,Cu不溶于盐酸,检验方法为:取适量固体于试管中,加足量盐酸,充分振荡,若红色固体无明显变化,则残留固体只有铜;
故答案为:取适量固体于试管中,加足量盐酸,充分振荡;红色固体无明显变化,残留固体只有铜.
猜想1:CuC2O4
| △ |
猜想2:CuC2O4
| △ |
故答案为:猜想1、猜想2;猜想1只有化合价的降低,猜想2只有化合价的升高,不符合氧化还原反应的原理;
II.(1)氮气性质稳定,对实验无干扰,通入氮气可以把装置中的气体排入检验装置中,而且使装置中气压稳定,防止产生倒吸;
故答案为:将分解生成的气体排到后面的装置中进行检验,并能防止倒吸;
(2)检验CO用CuO粉末,在加热条件下,CO还原CuO,则黑色固体变为红色,检验CO前要先干燥,所以E装置中为浓硫酸,用于干燥CO;
故答案为:浓硫酸;CuO;
(3)CO2能使澄清石灰水变浑浊,在加热条件下CO能还原CuO,则黑色固体变为红色,若只有CO2,则澄清石灰水变浑浊,其它装置中无明显现象;
故答案为:B中澄清石灰水变浑浊,其它装置中无明显现象;
III.气体产物只有CO2,C元素的化合价升高,则反应中Cu元素的化合价降低,则生成的固体中只有Cu,Cu不溶于盐酸,检验方法为:取适量固体于试管中,加足量盐酸,充分振荡,若红色固体无明显变化,则残留固体只有铜;
故答案为:取适量固体于试管中,加足量盐酸,充分振荡;红色固体无明显变化,残留固体只有铜.
点评:本题考查了探究物质的组成的实验方案设计,题目难度中等,注意把握氧化还原反应原理、物质的性质、常见物质的检验方法,侧重于考查学生的实验探究能力.

练习册系列答案
相关题目
NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、1.0LPH=1的H2SO4溶液中所含H+数为0.2 NA |
B、26g (聚乙炔)所含碳碳双键数为2 NA (聚乙炔)所含碳碳双键数为2 NA |
| C、1moAl13-团簇离子的最外层电子总数为40 NA |
| D、标准状况下,22.4LCO、CO2混合气体中所含碳原子数为2 NA |
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中R与T原子序数之和为20,下列判断正确的是( )
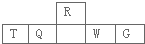

| A、离子半径:T>W |
| B、最高价氧化物对应水化物的酸性:Q>W>G |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物甲溶于水,其水溶液呈中性 |
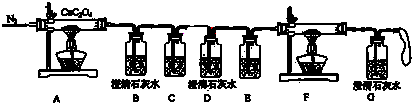
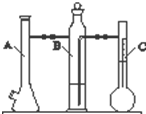 利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.