题目内容
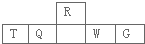
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中R与T原子序数之和为20,下列判断正确的是( )

| A、离子半径:T>W |
| B、最高价氧化物对应水化物的酸性:Q>W>G |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物甲溶于水,其水溶液呈中性 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:设R的原子序数为x,则T的原子序数为x+8-2,R与T原子序数之和为20,则x=7,为N元素,T为Al,Q为Si,W为S,G为Cl,
A.电子层数越多,半径越大,电子层结构相同的离子,质子数越大离子半径越小;
B.元素的非金属性越强,形成的最高价氧化物对应水化物的酸性越强;
C.元素的非金属性越强,最简单气态氢化物的热稳定性越强;
D.Al和Cl形成的化合物甲是AlCl3,氯化铝溶液水解显酸性.
A.电子层数越多,半径越大,电子层结构相同的离子,质子数越大离子半径越小;
B.元素的非金属性越强,形成的最高价氧化物对应水化物的酸性越强;
C.元素的非金属性越强,最简单气态氢化物的热稳定性越强;
D.Al和Cl形成的化合物甲是AlCl3,氯化铝溶液水解显酸性.
解答:
解:设R的原子序数为x,则T的原子序数为x+8-2,R与T原子序数之和为20,则x=7,为N元素,T为Al,Q为Si,W为S,G为Cl,
A.Al3+两个电子层,S2-有三个电子层,因此离子半径:S2->Al3+,故A错误;
B.非金属性:Cl>S>Si,最高价氧化物对应水化物的酸性:HClO4>H2SO4>H2SiO3,故B错误;
C.非金属性:N>P>Si,元素的非金属性越强,形成的气态氢化物越稳定,因此最简单气态氢化物的稳定性:NH3>SiH4,故C正确;
D.Al和Cl形成的化合物甲是AlCl3,氯化铝溶液水解显酸性,故D错误;
故选C.
A.Al3+两个电子层,S2-有三个电子层,因此离子半径:S2->Al3+,故A错误;
B.非金属性:Cl>S>Si,最高价氧化物对应水化物的酸性:HClO4>H2SO4>H2SiO3,故B错误;
C.非金属性:N>P>Si,元素的非金属性越强,形成的气态氢化物越稳定,因此最简单气态氢化物的稳定性:NH3>SiH4,故C正确;
D.Al和Cl形成的化合物甲是AlCl3,氯化铝溶液水解显酸性,故D错误;
故选C.
点评:本题考查了元素周期表和元素周期律的综合应用,为高频考点,题目涉及离子半径的比较、非金属性强弱的比较和盐类的水解,推导元素难度不大,因此掌握元素周期律是解题的关键,综合性强,难度中等.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
β-月桂烯的结构如图所示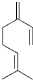 ,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
 ,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )| A、3种 | B、4种 | C、5种 | D、6种 |
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.某校课外兴趣小组以两条途径分别对X进行如下实验探究.下列有关说法不正确的是( )
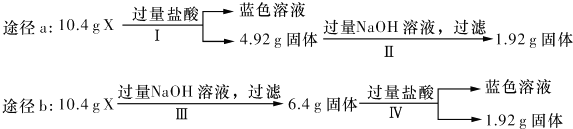

| A、由工可知X中一定存在Fe2 O3、Cu |
| B、无法判断混合物中是否含有Al2O3 |
| C、1.92 g固体成分为Cu |
| D、原混合物中m( Fe2O3):m(Cu)=1:1 |
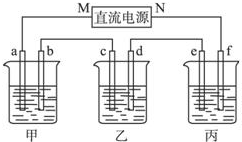 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
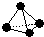 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是: