题目内容
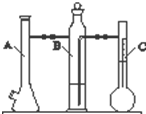 利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.实验步骤:
①装配好化学反应气体体积测定仪,作气密性检查.
②用砂纸擦去镁带表面的氧化物,然后称取0.100~0.110g的镁带,把数据记录于表格中.
③取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
④用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
⑤用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将硫酸注入A瓶,注入后迅速拔出针头.
⑥当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
⑦用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃;压强:101kPa.该条件下1mol氢气体积的理论值为24.5L.
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞,
可以确认装置气密性合格.
(2)B中所装液体一般是
A中发生反应的离子方程式为
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
| 实验 次数 | m(Mg)/g | 硫酸体 积/mL | 液体量瓶中 液体体积/mL | 抽出气体 体积/mL | 氢气体 积/mL | 计算1mol 氢气体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | x | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
②计算1mol氢气体积:两次实验的平均值=
③计算实验误差:
| 实验值-理论值 |
| 理论值 |
④引起该误差的可能原因是
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)装置气密性可以利用装置内气体压强变化和液面变化分析判断装置气密性;
(2)利用品红溶液呈红色便于观察液面调整,A中是镁和硫酸反应生成硫酸镁和氢气,依据产物写出离子方程式;
(3)①依据实验步骤分析,加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积;
②依据实验的数据计算两次体积平均值;
③依据实验误差计算公式和计算得到的数据计算;
④A、镁带中含有跟硫酸不反应的杂质,对反应生成氢气量减少,体积偏小;
B、镁条表面的氧化物没有除,部分氧化物和硫酸反应而没有气体生成,会导致气体体积偏小;
C、镁带中含有少量的铝,相同质量的镁和铝,铝生成的氢气多,所以会导致气体体积偏大;
D、所用稀硫酸不足量,镁条不能全部反应,生成氢气减小,体积偏小;
(2)利用品红溶液呈红色便于观察液面调整,A中是镁和硫酸反应生成硫酸镁和氢气,依据产物写出离子方程式;
(3)①依据实验步骤分析,加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积;
②依据实验的数据计算两次体积平均值;
③依据实验误差计算公式和计算得到的数据计算;
④A、镁带中含有跟硫酸不反应的杂质,对反应生成氢气量减少,体积偏小;
B、镁条表面的氧化物没有除,部分氧化物和硫酸反应而没有气体生成,会导致气体体积偏小;
C、镁带中含有少量的铝,相同质量的镁和铝,铝生成的氢气多,所以会导致气体体积偏大;
D、所用稀硫酸不足量,镁条不能全部反应,生成氢气减小,体积偏小;
解答:
解:(1)当A瓶加料口塞上橡胶塞,微热,储液瓶(B瓶)内导管中液面会上升,观察上升液面在一段时间内无明显下降,证明装置气密性完好;
故答案为:储液瓶(B瓶)内导管中液面会上升,观察上升液面在一段时间内无明显下降;
(2)品红溶液呈红色,比水更直观观察液面变化;装置中的反应是镁和硫酸反应生成硫酸镁和氢气的反应,反应离子方程式为:Mg+2H+═Mg2++H2↑;
故答案为:品红;Mg+2H+═Mg2++H2↑;
(3)①实验步骤分析,加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积;
图表数据分析气体体积X=110mL-10mL+6.5mL=106.5mL;
故答案为:106.5;
②实验1测定体积为106.5mL,计算得到1mol氢气的体积=
×1mol=25.9L;实验2测定氢气的体积=121mL-10mL+8mL=119mL,计算得到1mol氢气的体积=
×1mol=25.1L;两次测定的平均值=
=25.5L
故答案为:25.5;
③实验误差=
×100%=
×100%=4.08%
故答案为:4.08%;
④实际测得1mol氢气的体积为25.5L,理论上为22.4L,则实际上偏大,
A、镁带中含有跟硫酸不反应的杂质,对反应生成氢气量减少,体积偏小,故A错误;
B、镁条表面的氧化物没有除,部分氧化物和硫酸反应而没有气体生成,会导致气体体积偏小,故B错误;
C、镁带中含有少量的铝,相同质量的镁和铝,铝生成的氢气多,所以会导致气体体积偏大,故C正确;
D、所用稀硫酸不足量,镁条不能全部反应,生成氢气减小,体积偏小,故D错误;
故答案为:C.
故答案为:储液瓶(B瓶)内导管中液面会上升,观察上升液面在一段时间内无明显下降;
(2)品红溶液呈红色,比水更直观观察液面变化;装置中的反应是镁和硫酸反应生成硫酸镁和氢气的反应,反应离子方程式为:Mg+2H+═Mg2++H2↑;
故答案为:品红;Mg+2H+═Mg2++H2↑;
(3)①实验步骤分析,加入的硫酸溶液体积也计算在量气瓶中的液体体积,反应后抽出的气体体积调整液面平衡,所以需要在气体体积中加入抽出气体的体积;
图表数据分析气体体积X=110mL-10mL+6.5mL=106.5mL;
故答案为:106.5;
②实验1测定体积为106.5mL,计算得到1mol氢气的体积=
| 0.1065L×24.3g/mol |
| 0.100g |
| 0.119L×24.3g/mol |
| 0.115g |
| 25.9+25.1 |
| 2 |
故答案为:25.5;
③实验误差=
| 实验值-理论值 |
| 理论值 |
| 25.5-24.5 |
| 24.5 |
故答案为:4.08%;
④实际测得1mol氢气的体积为25.5L,理论上为22.4L,则实际上偏大,
A、镁带中含有跟硫酸不反应的杂质,对反应生成氢气量减少,体积偏小,故A错误;
B、镁条表面的氧化物没有除,部分氧化物和硫酸反应而没有气体生成,会导致气体体积偏小,故B错误;
C、镁带中含有少量的铝,相同质量的镁和铝,铝生成的氢气多,所以会导致气体体积偏大,故C正确;
D、所用稀硫酸不足量,镁条不能全部反应,生成氢气减小,体积偏小,故D错误;
故答案为:C.
点评:本题考查了探究物质的组成或测量物质的含量的实验设计,主要是测定物质氢气体积的方法和步骤,数值换算和数据应用,误差分析判断的依据,注意表格中数据的计算应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应的离子方程式书写错误的是( )
| A、向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C、1 L 2 mol?L-1的FeBr2溶液中通入2.5 mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 |
| D、在H2C2O4中加入酸性KMnO4溶液:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
下列关于16O和18O说法正确的是( )
| A、16O2与18O2互为同素异形体 |
| B、16O与18O核外电子排布方式不同 |
| C、通过化学变化可以实现16O与18O间的相互转化 |
| D、16O与18O是氧元素的两种核素 |
某有机化合物的结构简式为: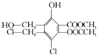 ,下列有关该物质的叙述正确的是( )
,下列有关该物质的叙述正确的是( )
 ,下列有关该物质的叙述正确的是( )
,下列有关该物质的叙述正确的是( )| A、1mol该物质最多可以消耗3 mol Na |
| B、1mol该物质最多可以消耗7 mol NaOH |
| C、不能与Na2CO3溶液反应 |
| D、易溶于水,可以发生加成反应和取代反应 |
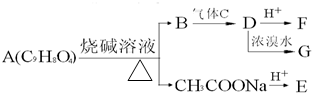 A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题: