题目内容
15.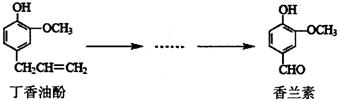 香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )| A. | 在丁香油酚分子中至少有12个原子共平面 | |
| B. | 常温下,1mol丁香油酚可与2molBr2反应 | |
| C. | 1moI香兰素最多能与4mol氢气发生加成反应 | |
| D. | 可用酸性KMnO4溶液检验丁香油酚中是否含有碳碳双键 |
分析 A.丁香油酚分子中苯环为平面结构,与苯环直接相连的原子在同一平面内;
B.由苯酚能发生邻对位取代,碳碳双键能发生加成反应来分析;
C.由苯环能与氢气加成、醛基能与氢气加成来分析;
D.碳碳双键、酚羟基都可被氧化.
解答 解:A.丁香油酚分子中苯环为平面结构,与苯环直接相连的原子在同一平面内,则7个C原子、3个H原子、2个O原子在同一平面内,至少有12个原子共平面,故A正确;
B.常温下,1mol丁香酚能发生取代反应、加成反应,共与2molBr2反应,故B正确;
C.苯环能与氢气加成、醛基能与氢气加成,则1mol香兰素最多能与4mol氢气发生加成反应,故C正确;
D.碳碳双键、酚羟基都可被氧化,不能用高锰酸钾检验,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,明确结构决定其性质、常见有机物的性质和结构式解答本题的关键,难度不大.

练习册系列答案
相关题目
5.如图中的有机化合物可能发生的化学反应有( )

①加成 ②氧化 ③加聚 ④取代.

①加成 ②氧化 ③加聚 ④取代.
| A. | ①② | B. | ①③④ | C. | ①②④ | D. | ①②③④ |
6.将含有0.4molNaCl和0.4molCu(NO3)2的水溶液1L用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另一个电极上放出气体的体积(标准状况)约为( )
| A. | 6.72L | B. | 5.6L | C. | 2.8L | D. | 13.44L |
3.某醇与足量的金属钠反应,产生的氢气与醇的物质的量之比为1:1,则该醇可能是( )
| A. | 乙二醇 | B. | 乙醇 | C. | 甲醇 | D. | 丙三醇 |
10.25℃,加水将10mL pH=11的氨水稀释至1L,则下列判断中正确的是( )
| A. | 稀释后溶液的pH=9 | |
| B. | 稀释过程中,溶液中所有离子的浓度均减小 | |
| C. | 稀释后溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$减小 | |
| D. | 该氨水稀释前后中和盐酸的能力相同 |
20.几种短周期元素的原子半径和主要化合价见表,下列有关说法中,正确的是( )
| 元素符号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 离子半径大小:r(X2+)>r(Q2-) | |
| B. | Y与Q形成的化合物不能跟氢氧化钠溶液反应 | |
| C. | M元素与L元素形成的一种化合物是常见的有机溶剂 | |
| D. | Z的单质可在氧气中燃烧生成ZO3 |
5.等温、等压下,Ag CO2所占的体积为11.2L,0.5A g X的气体所占的体积为7.7L,则气体的相对分子质量为( )
| A. | 16 | B. | 32 | C. | 48 | D. | 64 |