题目内容
16.科学家采用“组合转化”技术,将CO2在一定条件下转化为重要的化工原料乙烯:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g),正反应为吸热反应,该反应达到平衡后,改变横坐标表示的反应条件,下列图示错误的是( )| A. | 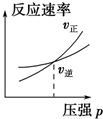 | B. | 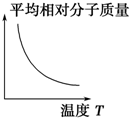 | C. | 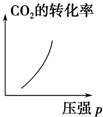 | D. | 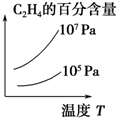 |
分析 对应反应2CO2(g)+6H2(g)?C2H4(g)+4H2O(g),正反应为吸热反应,增大压强,平衡正向移动,升高温度,平衡正向移动,以此解答该题.
解答 解:对应反应2CO2(g)+6H2(g)?C2H4(g)+4H2O(g),正反应为吸热反应,
A.因反应物气体的计量数之和大于生成物气体的计量数之和,则增大压强,平衡正向移动,正反应速率大于你反应速率,故A正确;
B.正反应吸热,则升高温度,平衡正向移动,因气体的物质的量减小,则平均相对分子质量增大,故B错误;
C.增大压强,平衡正向移动,二氧化碳的转化率增大,故C正确;
D.升高温度、增大压强,平衡都正向移动,乙烯的含量增大,故D正确.
故选B.
点评 本题主要考查的是化学平衡的影响因素,为高频考点,侧重于学生的分析能力的考查,影响因素有:温度、压强、催化剂、浓度等,熟练掌握此反应的反应特点是解决本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验.经充分反应后,瓶内溶质的物质的量浓度为,假设溶质不扩散( )
| A. | ①=② | B. | ①<② | C. | ①>② | D. | 不能确定 |
7.决定化学反应速率的最主要因素是( )
| A. | 反应物浓度 | B. | 反应温度 | ||
| C. | 反应物自身的性质 | D. | 是否使用催化剂 |
4.下列离子中,所带电荷数与该离子的核外电子层数相等的是( )
| A. | Al3+ | B. | S2- | C. | F- | D. | Mg2+ |
11.下列说法正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 由于共价键具有方向性,共价化合物在形成晶体时均采取“紧密堆积” | |
| D. | 反应NH4Cl (s)═NH3(g)+HCl(g)室温下不能自发进行,则该反应的△H>0 |
1.用现代化学方法测定某有机物结构:红外光谱图表征显示有C-H键、O-H键、C-O键的振动吸收;核磁共振谱图和质谱图如下,
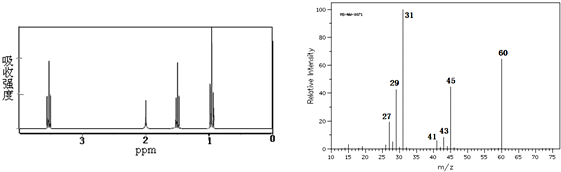
其分子结构简式为( )

其分子结构简式为( )
| A. | CH3CH2CH2OH | B. | CH3CH(OH)CH3 | C. | CH3CH2OCH3 | D. | CH3CH2CH2CHO |
5.下列各项实验操作与现象及结论或解释合理的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 福尔马林滴入高锰酸钾溶液 | 紫色褪去 | 高锰酸钾被还原 |
| B | 氯化钠晶体导电实验 | 不导电 | 晶体不存在离子 |
| C | AgI悬浊液滴入Na2S溶液 | 固体变黑 | Ksp(Ag2S)>Ksp(AgI) |
| D | 测量H2CO3的电离常数 | Ka1>Ka2 | H2CO3一级电离产生的H+对二级的电离起抑制作用 |
| A. | A | B. | B | C. | C | D. | D |
6.我国古代文献资料中记载了大量的化学研究过程与成果.下列选项不涉及化学变化的是( )
| 选项 | A | B | C | D |
| 原文 | 水火既济而土和 | 以曾青凃铁,铁赤色如铜 | 丹砂烧之成水银,积变又还成丹砂 | 欲去杂还纯,再入水煎炼,倾入盆中,经宿成白雪 |
| 解释 | 黏土烧结成陶瓷 | 金属的置换 | 物质间转化的可逆性 | 重结晶方法提纯物质 |
| A. | A | B. | B | C. | C | D. | D |