题目内容
4.下列离子中,所带电荷数与该离子的核外电子层数相等的是( )| A. | Al3+ | B. | S2- | C. | F- | D. | Mg2+ |
分析 离子Xm+、Yn-右上角m、n代表所带电荷数,阳离子失去最外层电子后电子层减少一层,阴离子得到电子后,电子层不改变,判断各离子具有的电子层数即可解答.
解答 解:A.Al3+所带电荷数为3,有2个电子层,离子所带电荷数与电子层不相等,故A错误;
B.S2-所带电荷数为2,有3个电子层,离子所带电荷数与电子层不相等,故B错误;
C.F-所带电荷数为1,有2个电子层,离子所带电荷数与电子层不相等,故C错误;
D.Mg2+所带电荷数为2,有2个电子层,离子所带电荷数与电子层相等,故D正确;
故选D.
点评 本题考查核外电子排布规律,比较基础,掌握原子核外电子排布和离子的核外电子排布即可解答.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
16.经初步检测蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2等组成.分析如图1:
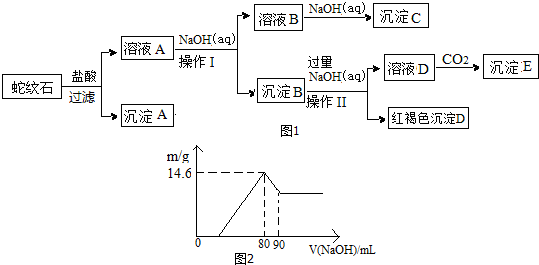
请回答下列问题:
(1)蛇纹石与盐酸充分反应后再过滤即可得溶液A.在过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)沉淀B的组成是Al(OH)3、Fe(OH)3,向溶液A中逐滴加入NaOH溶液,以控制溶液pH在C的范围内可得到符合图1关系的沉淀B.(填写下列正确选项前的字母.有关氢氧化物沉淀的pH见下表,且pH达到7.8时,氢氧化铝开始溶解.)
A.1~3 B.3~5 C.5~7 D.7~8
(3)写出向溶液D中通入过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)向溶液A中逐滴加入5mol•mol-1NaOH溶液,经过操作I和操作II得到的沉淀质量与V[NaOH(aq)]有图2所示的数据关系.经分析蛇纹石中Fe2O3与Al2O3的物质的量之比为2:1.

请回答下列问题:
(1)蛇纹石与盐酸充分反应后再过滤即可得溶液A.在过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)沉淀B的组成是Al(OH)3、Fe(OH)3,向溶液A中逐滴加入NaOH溶液,以控制溶液pH在C的范围内可得到符合图1关系的沉淀B.(填写下列正确选项前的字母.有关氢氧化物沉淀的pH见下表,且pH达到7.8时,氢氧化铝开始溶解.)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
(3)写出向溶液D中通入过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)向溶液A中逐滴加入5mol•mol-1NaOH溶液,经过操作I和操作II得到的沉淀质量与V[NaOH(aq)]有图2所示的数据关系.经分析蛇纹石中Fe2O3与Al2O3的物质的量之比为2:1.
17.下列对各组物质性质的比较中,正确的是( )
| A. | 沸点:HF<HCl | B. | 熔点:Al>Na | C. | 密度:H2O>MgCl2 | D. | 硬度:C<Si |
12.用锌与稀硫酸反应制H2时,下列能延缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量CH3COONa固体 | D. | 改用98%的浓硫酸 |
19.只用一种试剂就能区别乙醇、乙酸和葡萄糖三种溶液,该试剂是( )
| A. | 金属钠 | B. | 石蕊溶液 | ||
| C. | 新制的氢氧化铜悬浊液 | D. | NaHCO3溶液 |
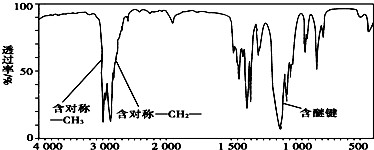
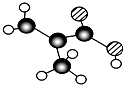 ,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).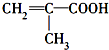 .
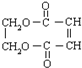
.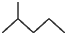 表示的有机物C的分子式为C6H14.
表示的有机物C的分子式为C6H14.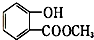 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.
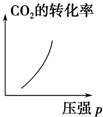
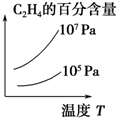
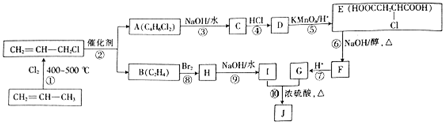
 .
. +3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.
+3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.