题目内容
8.同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验.经充分反应后,瓶内溶质的物质的量浓度为,假设溶质不扩散( )| A. | ①=② | B. | ①<② | C. | ①>② | D. | 不能确定 |
分析 设烧瓶体积为VL,①中溶液体积等于氨气的体积等于烧瓶的体积,根据气体的体积求出物质的量,再求出浓度;②中发生反应:3NO2+H2O=2HNO3+NO,根据气体的物质的量求出硝酸的物质的量,再根据溶液的体积求出浓度.
解答 解:同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验,经充分反应后,设烧瓶体积为VL,该条件下的气体摩尔体积为Vm,
①中溶液体积等于氨气的体积,溶液物质的量浓度为:$\frac{\frac{VL}{Vm}}{VL}$=$\frac{1}{{V}_{m}}$mol/L;
②中发生反应:3NO2+H2O=2HNO3+NO,3体积二氧化氮反应得到1体积NO,硝酸溶液体积为NO2体积的$\frac{2}{3}$,标准状况下NO2的体积为VL,则生成硝酸的物质的量为$\frac{2}{3}$×$\frac{V}{{V}_{m}}$mol,故硝酸溶液浓度为:$\frac{\frac{3}{2}×\frac{VL}{{V}_{m}}}{\frac{2}{3}VL}$=$\frac{1}{22.4}$$\frac{1}{{V}_{m}}$mol/L,
则溶液的物质的量浓度关系为:①=②,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算②中物质的量浓度为解答关键,注意掌握物质的量浓度与物质的量、气体摩尔体积之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
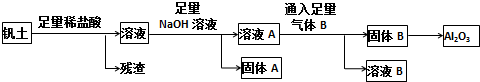
16.经初步检测蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2等组成.分析如图1:
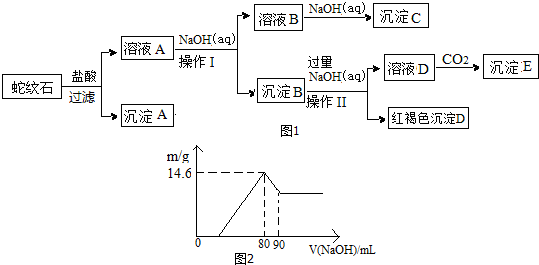
请回答下列问题:
(1)蛇纹石与盐酸充分反应后再过滤即可得溶液A.在过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)沉淀B的组成是Al(OH)3、Fe(OH)3,向溶液A中逐滴加入NaOH溶液,以控制溶液pH在C的范围内可得到符合图1关系的沉淀B.(填写下列正确选项前的字母.有关氢氧化物沉淀的pH见下表,且pH达到7.8时,氢氧化铝开始溶解.)
A.1~3 B.3~5 C.5~7 D.7~8
(3)写出向溶液D中通入过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)向溶液A中逐滴加入5mol•mol-1NaOH溶液,经过操作I和操作II得到的沉淀质量与V[NaOH(aq)]有图2所示的数据关系.经分析蛇纹石中Fe2O3与Al2O3的物质的量之比为2:1.

请回答下列问题:
(1)蛇纹石与盐酸充分反应后再过滤即可得溶液A.在过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)沉淀B的组成是Al(OH)3、Fe(OH)3,向溶液A中逐滴加入NaOH溶液,以控制溶液pH在C的范围内可得到符合图1关系的沉淀B.(填写下列正确选项前的字母.有关氢氧化物沉淀的pH见下表,且pH达到7.8时,氢氧化铝开始溶解.)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
(3)写出向溶液D中通入过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)向溶液A中逐滴加入5mol•mol-1NaOH溶液,经过操作I和操作II得到的沉淀质量与V[NaOH(aq)]有图2所示的数据关系.经分析蛇纹石中Fe2O3与Al2O3的物质的量之比为2:1.
13.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )
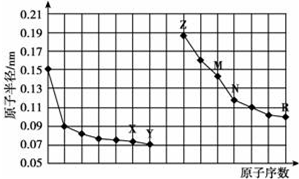

| A. | 简单离子的半径:X<Z<M | |
| B. | 最高价氧化物对应水化物的酸性:R<N | |
| C. | Y、R两种元素的气态氢化物稳定性:Y>R | |
| D. | 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
20.下列化学反应中,反应物总能量高于生成物总能量的是( )
| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
17.下列对各组物质性质的比较中,正确的是( )
| A. | 沸点:HF<HCl | B. | 熔点:Al>Na | C. | 密度:H2O>MgCl2 | D. | 硬度:C<Si |