题目内容
11.下列说法正确的是( )| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 由于共价键具有方向性,共价化合物在形成晶体时均采取“紧密堆积” | |
| D. | 反应NH4Cl (s)═NH3(g)+HCl(g)室温下不能自发进行,则该反应的△H>0 |
分析 A.煤的干馏和煤的液化都是化学变化;
B.原电池的负极是容易有被氧化的电极,易被腐蚀;
C.共价化合物原子晶体不能紧密堆积,不遵循“紧密堆积”原理;
D.当△G=△H-T•△S>0时,反应不能自发进行.
解答 解:A.煤的干馏是指将煤隔绝空气加强热使之分解的过程,煤液化生成甲醇,属于化学变化,故A错误;
B.锌活泼性强于铁,锡活泼性弱于铁,镀锌铁破损后仍然能够保护铁,镀锡铁破损后加速铁的腐蚀,故B错误;
C.原子晶体是原子以具有方向性和饱和性的共价键结合形成的,不能紧密堆积,不遵循“紧密堆积”原理,故C错误;
D.化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T•△S<0时,反应能自发进行,当△H<0,△S>0时,△G=△H-T•△S<0,在室温一定能自发进行,而△H>0,△S<0时不能自发进行,该反应的△S>0,反应:NH4Cl (s)═NH3(g)+HCl(g)在室温下不能自发进行,则室温下△G=△H-T•△S>0,说明△H>0,故D正确;
故选D.
点评 本题考查煤的综合利用、金属的腐蚀防护、晶体的堆积方式、反应的方向等知识,内容较为综合,难度不大,注意基础知识的掌握.

练习册系列答案
相关题目
19.只用一种试剂就能区别乙醇、乙酸和葡萄糖三种溶液,该试剂是( )
| A. | 金属钠 | B. | 石蕊溶液 | ||
| C. | 新制的氢氧化铜悬浊液 | D. | NaHCO3溶液 |
6.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
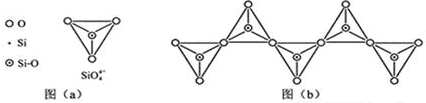
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.

3.下列有机物的系统命名正确的是( )
| A. | 2-乙基戊烷 | B. | 3-甲基-2-戊烯 | C. | 2-甲基-3-戊炔 | D. | 1-甲基-5-乙基苯 |
1.硫酸亚铁晶体( FeSO4•7H2O)俗称绿矾,加热至高温会发生分解,为确定绿矾分解产生的非金属氧化物,进行如下探究.
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3:非金属氧化物SO2、SO3.
(2)现设计如图所示实验装置(图中铁架台略去),检验绿矾的分解产物.
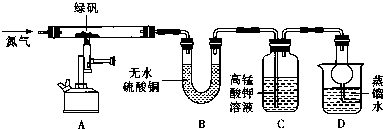
按上述装置进行实验,同学们观察到如下现象:
(3)结合实验现象,理论上分析可知绿矾分解还生成另一物质SO3.其理论依据是每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等于1:2,若只生成Fe2O3和SO2,S和O之比为1:3.5,元素不守恒,故可通过理论分析得出:绿矾分解还生成另一物质SO3.
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左一右),注明药品的名称[可供选择的药品有1mol/L NaOH溶液、0.5mol/L BaCl2溶液、0.5mol/L Ba(NO3)2溶液].
装置示意图现象结论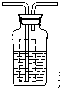 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
(5)根据上述实验,写出绿矾高温分解的化学方程式2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O.
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3:非金属氧化物SO2、SO3.
(2)现设计如图所示实验装置(图中铁架台略去),检验绿矾的分解产物.

按上述装置进行实验,同学们观察到如下现象:
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左一右),注明药品的名称[可供选择的药品有1mol/L NaOH溶液、0.5mol/L BaCl2溶液、0.5mol/L Ba(NO3)2溶液].
装置示意图现象结论
 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3(5)根据上述实验,写出绿矾高温分解的化学方程式2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O.
 .
.