题目内容
6.我国古代文献资料中记载了大量的化学研究过程与成果.下列选项不涉及化学变化的是( )| 选项 | A | B | C | D |
| 原文 | 水火既济而土和 | 以曾青凃铁,铁赤色如铜 | 丹砂烧之成水银,积变又还成丹砂 | 欲去杂还纯,再入水煎炼,倾入盆中,经宿成白雪 |
| 解释 | 黏土烧结成陶瓷 | 金属的置换 | 物质间转化的可逆性 | 重结晶方法提纯物质 |
| A. | A | B. | B | C. | C | D. | D |
分析 物理变化和化学变化的区别:物理变化没有新物质生成,化学变化有新物质生成,常表现为生成气体,颜色改变,生成沉淀等,而且伴随能量变化,常表现为吸热、放热、发光等,据此解答.
解答 解:A.水火既济而土和,即烧制陶瓷过程,陶瓷烧制过程中有新物质生成,属于化学变化,故A不选;
B.“曾青”是指可溶性铜盐,即用铁将铜的化合物中的铜置换出来,有新物质生成,属于化学变化,故B不选;
C.丹砂为硫化汞,不稳定,加热发生HgS$\frac{\underline{\;\;△\;\;}}{\;}$Hg+S,温度降低时,又可发生Hg+S=HgS,该过程中有新物质生成,属于化学变化,故C不选;
D.重结晶过程是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程,没有新物质生成,属于物理变化,故D选;
故选:D.
点评 本题考查了物理变化与化学变化的判断,明确是否有新物质生成是解题关键,注意重结晶原理.

练习册系列答案
相关题目
1.硫酸亚铁晶体( FeSO4•7H2O)俗称绿矾,加热至高温会发生分解,为确定绿矾分解产生的非金属氧化物,进行如下探究.
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3:非金属氧化物SO2、SO3.
(2)现设计如图所示实验装置(图中铁架台略去),检验绿矾的分解产物.
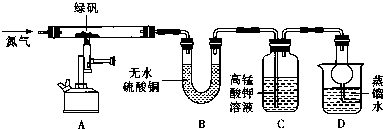
按上述装置进行实验,同学们观察到如下现象:
(3)结合实验现象,理论上分析可知绿矾分解还生成另一物质SO3.其理论依据是每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等于1:2,若只生成Fe2O3和SO2,S和O之比为1:3.5,元素不守恒,故可通过理论分析得出:绿矾分解还生成另一物质SO3.
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左一右),注明药品的名称[可供选择的药品有1mol/L NaOH溶液、0.5mol/L BaCl2溶液、0.5mol/L Ba(NO3)2溶液].
装置示意图现象结论 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
(5)根据上述实验,写出绿矾高温分解的化学方程式2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O.
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3:非金属氧化物SO2、SO3.
(2)现设计如图所示实验装置(图中铁架台略去),检验绿矾的分解产物.

按上述装置进行实验,同学们观察到如下现象:
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左一右),注明药品的名称[可供选择的药品有1mol/L NaOH溶液、0.5mol/L BaCl2溶液、0.5mol/L Ba(NO3)2溶液].
装置示意图现象结论
 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3(5)根据上述实验,写出绿矾高温分解的化学方程式2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O.
11.我国科学家屠呦呦因在青蒿素发现和治疗中的贡献,获得了诺贝尔生理学或医学奖,青蒿素是一种治疗疟疾的特效药.由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 青蒿素的分子式是C15H21O5 | |
| B. | 青蒿素在NaOH溶液中可以发生水解反应 | |
| C. | 反应②有H2O生成 | |
| D. | 青蒿素分子内的“-O-O-”基团可能对疟原虫有抑制作用 |
18.将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量不变的是( )
| A. | H2SO4 | B. | C2H5OH | C. | HNO3 | D. | NaOH |
15.某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如表:
(1)制取新制Cu(OH)2悬浊液的离子方程式为Cu2++2OH-═Cu(OH)2↓.
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净.向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:黄色沉淀消失,生成大量白色沉淀(或实验II与实验I的现象差异)与Cl-有关(或与SO42-无关).
检验Cu(OH)2洗涤干净的方法是取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净.
(3)同学们对白色沉淀的成分继续进行探究.查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸.它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液.
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl+2NH3•H2O═Cu(NH3)2++Cl-+2H2O、4Cu(NH3)2++8NH3•H2O+O2═4Cu(NH3)42++4OH-+6H2O.
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如图:
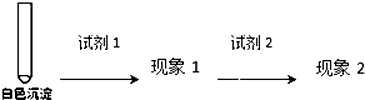
填写如表空格:
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式:2Cu(OH)2+2Cl-+SO2═2CuCl↓+SO42-+2H2O.
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O.完成合理的实验方案:取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同),则说明砖红色沉淀是Cu2O.
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入 | 实验Ⅰ | 1.5mL 1mol•L-1 CuSO4溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL 1mol•L-1 CuCl2溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净.向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:黄色沉淀消失,生成大量白色沉淀(或实验II与实验I的现象差异)与Cl-有关(或与SO42-无关).
检验Cu(OH)2洗涤干净的方法是取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净.
(3)同学们对白色沉淀的成分继续进行探究.查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸.它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液.
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl+2NH3•H2O═Cu(NH3)2++Cl-+2H2O、4Cu(NH3)2++8NH3•H2O+O2═4Cu(NH3)42++4OH-+6H2O.
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如图:

填写如表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O.完成合理的实验方案:取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同),则说明砖红色沉淀是Cu2O.
16.检验KCl溶液中是否混有Fe3+时,可选择的试剂是( )
| A. | 硫氰酸钾溶液 | B. | 硝酸 | C. | 盐酸 | D. | 硫酸 |
 工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.
工业含铬废水的处理原理是将CrO32-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源,以废治废,还能节约生成本.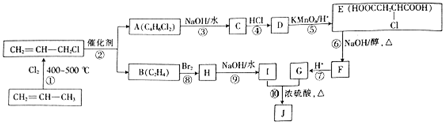
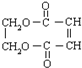 .
.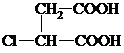 +3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.
+3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.