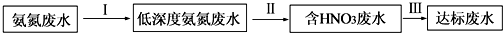题目内容
8.纯水中c(H+)=5×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L,若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=5.0×10-11 mol/L在该温度时,往水中滴入NaOH溶液,溶液中的c(OH-)=5.0×10-6mol/L,则溶液中c(H+)=5×10-8mol/L.分析 根据纯水中c(OH-)=c(H+),溶液显示中性进行分析;
根据该温度下纯水中氢离子浓度和氢氧根离子浓度,计算出水的离子积,
若温度不变,根据稀硫酸溶液中氢离子浓度和水的离子积计算出溶液中氢氧根离子的浓度,
若温度不变,依据氢氧化钠溶液中氢氧根离子浓度,结合离子积常数计算溶液中氢离子浓度.
解答 解:纯水显示中性,c(OH-)=c(H+)=5.0×10-7mol/L;
此温度下,水的离子积为:Kw=5.0×10-7×5.0×10-7=2.5×10-13,
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,硫酸溶液中氢离子浓度c(H+)=5.0×10-3mol/L,c(OH-)=$\frac{2.5×1{0}^{-13}}{5.0×1{0}^{-3}}$mol/L=5.0×10-11 mol/L,
在该温度时,往水中滴入NaOH溶液,溶液中的c(OH-)=5.0×10-6mol/L,则溶液中c(H+)=$\frac{2.5×1{0}^{-13}}{5.0×1{0}^{-6}}$mol/L=5×10-8mol/L,
故答案为:5.0×10-7mol/L;5.0×10-11mol/L;5×10-8mol/L.
点评 本题考查了水的离子积常数的有关计算,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,题目难度中等.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
18.下列有机物中,所有的碳原子不可能都共面的是( )
| A. |  | B. |  | C. |  | D. |  |
19.下列我国古代技术应用中,其工作原理不涉及化学反应的是( )
| A. | 黑火药爆炸 | B. | 用铁矿石炼铁 | C. | 湿法炼铜 | D. | 转轮排字 |
16.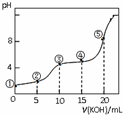 常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
 常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )| A. | 点②溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| B. | 点③溶液中:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) | |
| C. | 点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05 mol•L-1 | |
| D. | 点⑤溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |