题目内容
18.NaNO3溶液中含有NaCl、Na2SO4杂质,现选择适当的试剂将其转化为相应的沉淀除去,从而得到较为纯净的NaNO3.实验过程用下列流程图表示: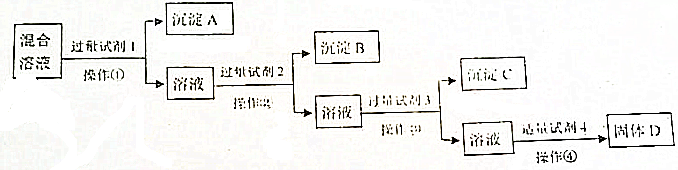
(1)写出上述实验过程中所用试剂的化学式:
试剂1BaCl2[或Ba(NO3)2]试剂2AgNO3试剂3Na2CO3试剂4HNO3
(2)加入过量试剂3的目的是使溶液中的Ag+、Ba2+完全沉淀
(3)恰当地控制试剂4的加入量的方法是测定溶液pH
(4)在加入试剂4后,获得固体D的实验操作④是蒸发(填操作名称)
(5)实验室利用上述实验获得的NaNO3晶体制备480mL0.4mol/L的NaNO3溶液:
①需要称取NaNO3固体17.0g;
②实验中需要用到的玻璃仪器有烧杯、胶头滴管、玻璃棒及500mL容量瓶.
分析 如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量试剂1为BaCl2[或Ba(NO3)2],生成沉淀A为BaSO4沉淀,然后在滤液中加入过量的试剂2为AgNO3,使Cl-全部转化为沉淀B为AgCl沉淀,在所得滤液中加入过量试剂3为Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入试剂4为稀HNO3,最后进行蒸发操作可得固体NaNO3,以此来解答.
解答 解:由流程可知,先加入过量试剂1为BaCl2[或Ba(NO3)2],生成沉淀A为BaSO4沉淀,然后在滤液中加入过量的试剂2为AgNO3,使Cl-全部转化为沉淀B为AgCl沉淀,在所得滤液中加入过量试剂3为Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入试剂4为稀HNO3,最后进行蒸发操作可得固体NaNO3,
(1)由上述分析可知,试剂1、2、3、4分别为BaCl2[或Ba(NO3)2]、AgNO3、Na2CO3、HNO3,故答案为:BaCl2[或Ba(NO3)2];AgNO3;Na2CO3;HNO3;
(2)加入过量试剂3的目的是使溶液中的Ag+、Ba2+完全沉淀,故答案为:使溶液中的Ag+、Ba2+完全沉淀;
(3)硝酸的量不可加入太多,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,发生:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,可通过测定溶液pH的方法判断反应是否已经完全,
故答案为:测定溶液pH;
(4)在加入试剂4后,获得固体D的实验操作④是蒸发,故答案为:蒸发;
(5)实验室利用上述实验获得的NaNO3晶体制备480mL0.4mol/L的NaNO3溶液:
①需要称取NaNO3固体为0.5L×0.4mol/L×=85g/mol=17.0g,故答案为:17.0;
②实验中需要用到的玻璃仪器有烧杯、胶头滴管、玻璃棒及500mL容量瓶等,故答案为:500mL容量瓶.
点评 本题考查物质的分离提纯操作,为高频考点,把握分离流程中的反应及混合物分离方法为解答的关键,注意离子沉淀的先后顺序,侧重分析与实验能力的综合考查,题目难度中等.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案 如图是N2(g)+3H2(g)═2NH3(g)在反应过程中的反应速率v与时间(t)的关系曲线,下列说法错误的是( )
如图是N2(g)+3H2(g)═2NH3(g)在反应过程中的反应速率v与时间(t)的关系曲线,下列说法错误的是( )| A. | t1时,正方向速率大于逆反应速率 | |
| B. | t2时,反应体系中NH3的浓度达到最大值 | |
| C. | t2-t3时间段,正反应速率等于逆反应速率 | |
| D. | t2-t3时间段,各物质的浓度相等且不再发生变化 |
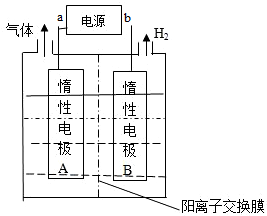
| A. | 外加电源的a极为正极 | |
| B. | 电解过程中,Li+向B极迁移 | |
| C. | 阳极反应式为:4OH--4e-═O2↑+H2O | |
| D. | 每生成1molLiOH,外电路转移1mol电子 |
| A. | HCl | B. | CaCO3 | C. | H2O | D. | NaOH |
 阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.
阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.